LE CYCLE CELLULAIRE
d'après le cours de B. Arcangioli
INTRODUCTION
Tous les organismes sont constitués de cellules
qui se multiplient par division cellulaire. Un adulte humain a environ
100.000 milliard de cellules, toutes originaires d'une même cellule,
la cellule œuf fertilisée. Chez un adulte, on trouve une quantité
énorme de cellules en division continue remplaçant celles
qui disparaissent. Avant qu'une cellule puisse se diviser, il faut qu'elle
grandisse jusqu'à une certaine taille, qu'elle duplique ses chromosomes,
qu'elles séparent ses chromosomes avec une distribution exacte
entre les 2 cellules filles. Tous ces processus sont coordonnée
durant le cycle cellulaire.

Vue générale du cycle cellulaire
Les 3 lauréats du prix Nobel de Physiologie &
Médecine en 2001 ont fait une découverte fondamentale concernant
le contrôle du cycle cellulaire : ils ont identifié les molécules
clés qui régulent le cycle cellulaire chez tous les organismes
eucaryotes, incluant les plantes, les levures, les animaux et les humains.
Ces découvertes fondamentales ont eu un grand impact sur tous les
aspects de la croissance cellulaire. Des déficiences dans le contrôle
cellulaire peuvent mener à des types d'altérations chromosomiques
vu dans les cellules cancéreuses : ceci ouvre à long terme
de nouvelles possiblités sur le traitement du cancer.
Leland Hartwell (né en 1939)
du Fred Hutchinson Research Center, Seattle, Etats-Unis : Il a été
récompensé pour ses découvertes de classes de gènes
spécifiques qui contrôle le cycle cellulaire. Un de ces gènes
appelé "start" a été trouvé comme
ayant un rôle centrale dans le contrôle de la première
étape de chaque cycle cellulaire. Hartwell a également introduit
le concept de "checkpoint", qui permet de comprendre le cycle
cellulaire.
Paul Nurse (né en 1949), de l'Imperial
Cancer Research Fund, Londre, Grande Bretagne : Il a identifié,
cloné et caractérisé par des méthodes de biologie
moléculaire et génétique l'un des régulateurs
clé de du cycle cellulaire, la CDK (Cyclin Dependent Kinase). Il
a montré que laa fonction de la CDK été hautement
conservé durant l'évolution. La CDK dirige le cycle cellulaire
de la cellule par la modification chimique (phospohorylation) d'autres
protéines.
Timothy Hunt (né en 1943), de
l'Imperial Cancer Research Fund, Londre, Grande Bretagne : il a été
récompensé pour sa découverte sur les cyclines, des
protéines qui régulent la fonction du CDK. Il a montré
que les cyclines sont dégradées périodiquement à
chaque division, un mécanisme prouvant l'importance générale
du cycle cellulaire.
I- UN MILLIARD DE CELLULES PAR GRAMME DE TISSU
Les cellules ayant leurs chromosomes localisés
dans le noyau et séparés du reste de la cellule, appelé
aussi cellules eucaryotes (les cellules procatyotes non pas de noyau),
sont apparues sur Terre il y a environ deux muilliard d'années.
Les organisme constitués par ces cellules peuvent être unicellulaire,
comme les levures ou les amibes, ou multicellulaire, comme les plantes
ou les animaux. Le corps humain contient un nombre énorme de cellules,
d'une quantité d'environ un milliard de cellules par gramme de
tissu. Chaque noyau cellulaire contient notre matériel héréditaire
entier (l'ADN), localisé dans 46 chromosomes (23 paires de chromosomes).
Il été connu depuis plus de cent ans que les cellules se
multiplient par division. C'est pourtant au cours des vingts dernières
années qu'il est devenu possible d'identifier les mécanismes
qui régule le cycle cellulaire et par extension la division cellulaire.
Ces mécanismes fontamentaux sont hautement conservés à
travers l'évolution et opèrent de la même manière
chez tous les organismes eucaryotes.
II- LES PHASES DU CYCLE CELLULAIRE
Le cycle cellulaire consiste en plusieurs phase :
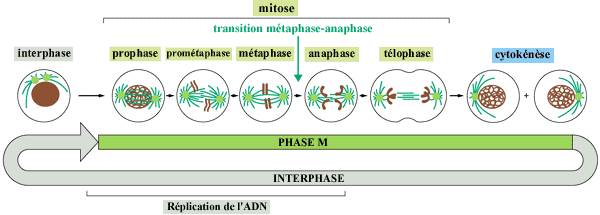
Durant la première phase (phase G1),
la cellule croit et devient plus large. Il y a synthèse des protéines.
Lorqu'elle atteind une certaine taille, elle entre dans la deuxième
phase (phase S), dans laquelle débute la synthèse de l'ADN.
On ne connait pas les mécanismes permettant le passage de la phase
G1 à la phase S. La cellule duplique sont matériel
héréditaire (réplication de l'ADN) et une copie de
chacun de ses chromosomes est effectuée. Durant la phase suivante
(phase G2), la cellule contrôle que la réplication
de l'ADN a bien été réalisée (réparation
post-réplicative) et prépare la division cellulaire. Les
chromosomes sont séparés (phase M pour Mitose) et la cellule
se divise en deux cellules filles. A travers ce mécanisme, les
deux cellules filles sont dotées des mêmes chromosomes que
ceux de la cellule mère. Après la division, les cellules
retournent en phase G1 et le cycle cellulaire est bouclé.
La durée du cycle cellulaire varie entre les différent type
de cellule (chez l'homme, il existe plus de 200 types cellulaires). Chez
la plus part des cellules de mammifère, celà dure entre
10 et 30 heures. Les cellules en phase G1 ne poursuivent pas
toujours le cycle cellulaire. Elles peuvent quitter le cycle cellulaire
et et entrer en phase d'attente (phase G0).
III- LE CONTROLE DU CYCLE CELLULAIRE
Pour les organismes eucaryotes vivant, il est indispensable
que les différentes phases du cycle cellulaire soient précisemment
coordonées. Les phases doivent suivre un ordre correct, et une
phase doit être terminé avant que la phase suivante ne démarre.
Les erreurs de coordination peuvent conduire à des altérations
chromosomiques. Des chromosomes ou des parties de chromosomes peuvent
être perdus, réarrangés ou ditribués de manière
inéquitables entre les deux cellules filles. Ces types d'altérations
chromosomiques sont souvent observées chez les cellules cancéreuses.
C'est Leland Hartwell qui, par des méthodes d'étude génétique
sur Saccarymyces cerevisae, identifia une centaine de gène impliqué
spécifiquement dans le contrôle du cycle cellulaire : ces
gènes sont appelés gènes CDC (Cell Divison Cycle).
Un de ces gènes, appelé CDC28, contrôles la première
étapes de progression vers la phase G1 et fût
pour celà appelé gène"start". Paul Nurse
découvrit chez la levure Schizzosacharomyces pombe un gène
équivalent à celui trouvé par Leland Hartwell, contrôlant
la transition G1/S, mais également la transition G2/M.
Il a montré ensuite que ce gène contrôle également
d'autre phases du cycle cellulaire. En 1987, il découvre son équivalent
humain, qu'il appelle CDK1 (Cyclin Dependent Kinase 1). Ce gène
encode pour une protéine qui est membre de la famille des CDK (Cyclin
Dependent Kinase). Paul Nurse montre également que l'activation
des CDK est dépendante d'une phosphorylation réversible.
Il a depuis été trouvé une douzaine de molécules
de CDK différentes chez l'homme.
Ceux sont donc les gènes CDK, chez l'homme, qui contrôle
les différents passage du cycle cellulaire, et la concentration
des protéines CDK ne varie pas.
Tim Hunt découvre au début des année 80 les premières
molécules de cyclines. Les cyclines sont des protéines formées
et dégradées au cours du cycle cellulaire. Elles ont été
appelé cycline car le concentration varie périodiquement
au cours du cycle cellulaire. Les cyclines se fixent sur les molécules
de CDK, régulant l'activité des CDK en phosphorylant les
protéines. La dégradation périodique de ces protéines
est un mécanisme important du contrôle du cycle cellulaire.
Les cyclines, comme les CDK, ont été conservées chez
toutes les espèces au cours de l'évolution. On dénombre
aujourd'hui 10 cyclines différentes chez l'homme.

Vue générale de la régulation du cycle cellulaire
par les complexe cyclines/cdk
A - Fonctions des différents
complexes cdk/cycline

Les principaux complexes CDK/Cyclines dans cycle cellulaire
1- Les cdk associées aux cyclines de G1
La progression en phase G1 nécessite la participation
des cyclines de type D qui
répondent aux facteurs de croissance au niveau du point de restriction,
moment où la cellule prend la décision d'entrer en phase
S. Les kinases cyclines D-dépendantes
(cdk lié à la cycline D) phosphorylent entre autre le produit
de l'anti-oncogène Rb (protéine du rétinoblastome),
permettant in vivo la libération de facteurs de transcription
(e2F et DP1) qui contrôlent l'expression de protéines requise
pour la phase S)
Cdk3
dont la cycline associée n'a pas encore été identifiée
est nécessaire à la transition G1/S dans les cellules de
mamifère, Cdk3 activant
les facteurs de transcription e2F-1, e2F-2 et e2F-3.
Le complexe cdk2/cycline
E est un des acteurs principaux de la phase S. Une de
ses fonctions se situerait au niveau de l'initiation de la synthèse
de l'ADN. Ce complexe est la cible des facteurs anti-prolifératifs
tel le facteur TGF-b (Transforming Growth Factor
b) qui bloque le cycle en phase G1. Ce complexe
contrôle également la transcription via l'hyperphosphorylation
de Rb. La cycline E est rapidement dégradé dès que
la réplication débute.
La cycline
A, également appelé "cycline
mitotique", intervient au début de la réplication
en s'associant à cdk2.
Ce complexe est nécessaire pour la poursuite de la réplication
de l'ADN. Le complexe cdk2/cycline
A contrôle également la durée de la
phase S en inactivant les facteurs e2F et DP1 par phosphorylation.
2- Les cdk associées aux cyclines mitotiques
La cycline A,
associée à cdc2,
intervient dans la préparation de la mitose. L'entrée en
phase M est gouvernée par le complexe cdc2/cycline
B. Ce complexe, responsable de la dissolution des lamines
nucléaire qui entraîne la rupture de l'enveloppe du noyau
à la mitose, intervient également dans la condensation de
la chromatine et dans l'organisation du fuseau de division. Il interviendrait
également dans la cytokénèse. Outre les protéines
structurales, cdc2/cycline
B phosphoryle également un grand nombre de protéines
régulatrices, comme des kinases et des phosphatases.
3- Les autres complexes cdk/cycline
Il existe d'autre complexe cdk/cycline dont voici quelques exemples:
-cdk7/cycline H, qui intervient à
plusieurs phase du cycle en temps qu'activateur des cdk.
-cdk5/p35 (p35 est un régulateur
non apparenté aux cyclines) , intervenant dans les mécanismes
de différenciation neuronales
-cdk9/cycline T, qui interagit directement
avec la protéine Tat du VIH.
B - Régulation des cdk
Les cdk sont régulées par des mécanismes
d'activation et d'inhibition.
Les mécanismes activateurs des cdk comprennent d'une part la liaison
de la kinase à la cycline et d'autre part, la phosphorylation du
résidus activateur conservé dans la famille des cdk (par
exemple Thr-161 pour cdc2).
Les mécanismes inhibiteurs interviennent à des degrès
divers selon les cdk. Il peut s'agir de phosphorylation de résidus
inhibiteurs (par exemple Thr-14 et Tyr-15 pour cdc2) ou encore d'interaction
entre les complexes cdk/cycline et les CKI (Cyclin Dependant Kinase Inhibitor).
1- Régulation des cdk par les cyclines
L'importance des cyclines dans la régulation des cdk s'établit
à différent niveaux: l'activation, la spécificité
du substrat et la localisation intracellulaire des cdk.
1-1 Régulation des cyclines
Les cyclines, la cycline D mis à part, sont
caractérisées par leur apparitions périodiques
à des moments précis du cycle. Ces variations sont fonctions
des niveaux de transcription des ARNm et de dégradation des cyclines.
Le facteur de transcription e2F stimule la transcription des cyclines
E et A en phase S. Or, ceux sont les
kinases cyclines D-dépendantes qui permettent
in vivo la libération du facteurs de transcription e2F.
D'une manière générale, les cyclines favorisent
donc l'expression des cyclines de la phase suivante et répriment
l'expression ou favorisent la dégradation des cyclines de la
phase précédente.
Des mécanismes de dégradation des cyclines sont mis en
place afin d'assurer la progression de la cellule dans le cycle. La
protéolyse d'une cycline est indispensable à l'inactivation
de la cdk associée. Le mécanisme de destruction fait intervenir
une "boite de destruction" qui semble marquer la cycline pour
la fixation de molécules d'ubiquitine (phénomène
d'ubiquitination).
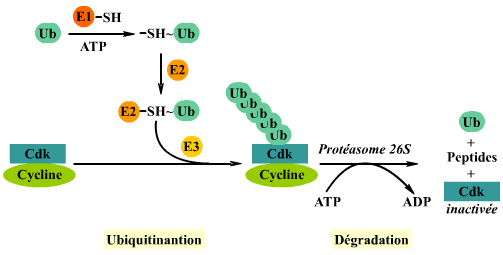
Les cyclines, ainsi que d'autres protéines telles que CKI,
sont dégradées par protéolyse. Grâce aux
enzymes E1, E2 et E3, les molécules d'ubiquitine se fixent au
substrat. Celui-ci qui est alors reconnu par le protéasome 26S
ce qui entraine la dégradation de la cycline et l'inactivation
de la cdk.
En dehors de la cycline D, plus stable, les cyclines
de la phase G1 ont une durée de vie très courte. Cette
instabilité serait due à la présence de la séquence
PEST. La protéolyse des cyclines de phase G1 fait appel aux molécules
d'ubiquitine. Il faut égalment queles cycline E soient phosphorylées.
La dégradation des cycline G1 requiet, chez S. Cerevisiae, l'enzyme
de conjugaison CDC34 (ou E2)
dont l'activité dépend de l'état de phosphorylation
de ces substrats. Cette voie semble être conservé chez
les vertébrés.
Les cyclines jouant un rôle en sortie de mitose sont elles dégradé
par la voie d'ubiquitination faisant intervenir le complexe APC (pour
Anaphase Promoting Complex ou E3)
Deux voies de dégradation sont donc impliquées dans la
progression du cyle cellulaire : l'une impliquant cdc34 (ou E2)
en G1/S, l'autre impliquant le complexe APC (ou E3)
à la sortie de la mitose.
1-2 Activation des cdk par les cyclines
L'activité des cdk est régulées de façon
post-transcriptionnelle par leur liaison aux cyclines. Cette régulation
est due à des changements de conformation des cdk engendrées
par la liaison cdk-cycline. Cette liason engendre des changements conformationnels
de la cdk permettant l'accés au site catalytique et rendant possible
les phosphorylations activatrices et inhibitrices en ce qui concerne
certaine cdk.
1-3 Influence des cyclines sur la spécificité
de substrat
Différents exemples témoignent de l'implication des cyclines
dans la détermination des substrats de cdk. Par exemple, le complexe
cdk2/cycline
A phosphorylent 10 fois plus efficacement la protéine
p107 (apparentée à pRb) que le complexe cdk2/cycline
B1. Ceci serait dû à une association
directe entre p107 et la cycline A.
Ainsi, les cyclines sont aussi importantes que la sous unité
catalytique dans le contrôle de la phosphorylation d'un substrat
donné.
1-4 Influence des cyclines sur la localisation
intracellulaire
La localiation intracellulaire des complexes cdk/cycline dépend
de la cycline elle-même. C'est le cas, par exemple, de la cycline
B qui possède un domaine CRS (Cytoplasmique Retention Signal)
impliqué dans la rétention du complexe dans le cytoplasme
avant la translocation dans le noyau.
2- Régulation par phosphorylation
Les 2 sous-unités cdk et cyclines sont sujettes à des changements
de phosphorylation. Si la régulation de la phosphorylation des
cyclines n'est pas bien comprise, il n'en est pas de même de celle
des cdk. L'activité des cdk est régulées par les
phosphorylations activatrices (sur le residus Thréonine ou Sérine
selon des cdk) et les phosphorylationinhibitrices (sur le résidus
Tyrosine et/ou Thréonine).

Régulation des complexes cdk/cyclines par phosphorylation
Il existe en fait 2 niveau de régulation par phosphorylation
des complexes cdk/cyclines : une phosphorylation inhibitrice ou activatrice
(ou une déphosphorylation) directe sur les cdk, ou bien une régulation
indirecte via la phosphorylation inhibitrice ou activatrice des complexes
régulateurs
Il existe en outre 2 type de phophorylation : des phosphorylation inhibitrice,
et des phosphorylation activatrice des complexes, ces phosphorylation
n'agissant pas sur les même résidus.
Prenons l'exemple de la régulation de l'activation du complexe
cdc2/cycline
B:

Activation du complexe par phosphorylation activatrice de la Thréonine161
de cdc2 par CAK (Cdk Activating
Kinase)
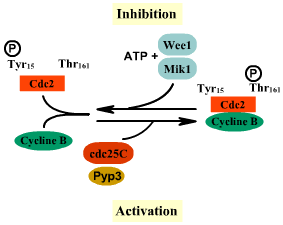
Inhibition du complexe par déphosphorylation de la Thréonine161
de cdc2 et phosphorylation
inhibitrice de la Tyrosine15 par coopération des kinases
Wee1 er Mik1
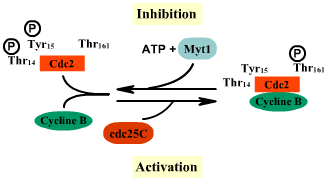
Inhibition du complexe par déphosphorylation de la Thréonine161
de cdc2 et phosphorylation
inhibitrice de des résidus Tyrosine15 et Thréonine14
par la kinase Myt1. Ce complexe inhibé peut être réactivé
par cdc25 qui déphosphoryle les résidus Tyrosine15
et Thréonine14
Dans cet exemple, Wee1
et Mik1 inhibe le complexe
cdc2/cycline
B. Mais ces kinases peuvent être également
inhibées par phophorylation inhibitrice par cdr/Nim1,
empêchant ainsi leurs action de phosphorylation inhibitrice sur
le complexe cdc2/cycline
B. L'action de cdc2 résulte alors de l'inhibition
des kinases Wee1 et Mik1
et de l'activation de la phosphatase cdc25.
3- Régulation par les CKI (Cyclin Dependant
Kinase Inhibitor)
Un troisième niveau de régulation des complexes cdk/cyclines
est apparu avec la découverte des inhibiteurs de cdk, les CKI.
L'intervention des CKI permet de comprendre comment les signaux extra-
et intracellulaires régulent la progression du cycle cellulaire.
D'autre part, le fait que les CKI soient, soit des suppresseurs de tumeurs
soit régulé par ceux-ci, permet d'établir le lien
entre le cycle et le développement des tumeurs.
Les CKI exercent leur activité inhibitrice en s'associant avec
les cdk ou le complexe cdk/cycline. Elles peuvent bloquer l'engagement
d'une phase mais peuvent également agir au cours d'une phase du
cycle cellulaire.
Les CKI sont réparties en deux groupes : la famille des Ink4 (Inhibitor
of cdk4) qui comprend différent membre et la famille
Cip/Kip représentée par p21Cip1, p27Kip1
et p57Kip2.
Prenons l'exemple de la CKI p21Cip1.
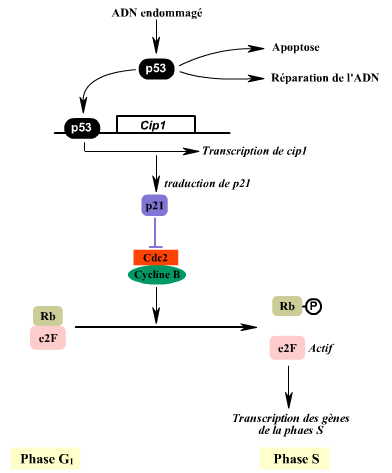
Le taux de p53 augmente lorsque l'ADN est endommagé. p53 peut
alors conduire la cellule vers l'apoptose ou stimuler la réparation
de l'ADN ou provoquer l'arrêt du cycle. L'arrêt en G1
est en effet induit par p53 qui active la transcription du gène
Cip1 codant pour p21, inhibiteur de cdk/cyclines
Il est a noté que p21 n'est pas le seul médiateur
de p53. p21 serait plutôt impliqué dans les processus de
différenciation en tant que promoteur de l'arrêt du cycle.
C- Les inhibiteurs chimiques de cdk
Les cdk sont régulées par l'intervention de molécules
activatrices ou inhibitrices, à des moments précis du cyle
cellulaire. Les inhibiteurs chimiques des cdk sont susceptibles d'agir
sur leurs cibles en interférant avec la liaison aux substrats ou
à l'ATP, en interagissant avec les sites activateurs des cdk, en
empêchant l'activation par les cyclines, en mimant l'activation
des CKI, en agissant sur le mécanisme de destruction des cyclines
ou en intervenant dans la localisation cellulaire du comlexe. Ces inhibiteurs
de cdk sont souvent des compétiteur de l'ATP et agisse en se fixant
sur le site de fixation del'ATP. Ces inhibiteurs chimiques bloquant la
prolifération cellulaire par inactivation des cdk/cyclines sont
des anti-tumoraux potentiels. On trouve par exemple le flavopiridol qui
empêche in vivo l'évolution des tumeurs et stimule leur régresion
en influençant l'entrée des cellules en apoptose.
Depuis peu, des équipes se consacre à l'élaboration
de peptide CKI, afin de rétablir la fonction de ces supresseurs
de tumeur souvent mutés dans les cellules malignes. On peut dire
que le prix Nobel qui récompensa en 2000 les découverte
de base sur le cycle cellulairedonne un signe encourageant à la
recherche biomédicale qui bénéficie aujourd'hui de
ces découvertes et les utilise pour développer, entre autre,
de nouvelle thérapie contre le cancer.
BIBLIOGRAPHIE:
- J Pines 1995. Cyclins and cyclin-dependent kianse :
a biochemical view. Biochem J, 308:679-711
|