NEUROIMMUNOLOGIE VIRALE – VIRUS NEUROTROPES
d'après le cours de Monique LAFON - 15
Janvier 2001 mlafon@pasteur.fr
INTRODUCTION
Il est acquis que les règles qui régissent
le fonctionnement du système immunitaire (SI) au niveau du système
nerveux (SN) sont différentes de celles qui régissent le
fonctionnement du système immunitaire global. Et qu'en cela il
s'agit d'une particularité régionale au même titre
que l'immunité mucosale.
L'ensemble des règles très particulières
qui contrôlent l'accès du système immunitaire et son
fonctionnement au niveau du système nerveux (moelle épinière,
œil et cerveau) font de ces organes des sites « immun privilégié
». Ces organes constituent des lieux immunitairement privilégiés
parce qu'ils sont à l'abri de la réponse immunitaire qui
pourrait être délétère pour leur bon fonctionnement.
Le privilège immun résulte :
1. De la présence d'une barrière hémato-méningée
imperméable aux anticorps et aux cellules immunitaires non activées
2. De mécanismes diminuant la présentation antigénique
3. De mécanismes induisant l'apoptose des cellules activées
qui, elles, peuvent passer la barrière hémato-méningée
4. De la pauvreté en cellules présentatrices d'antigènes
professionnelles
5. De l'absence de canaux lymphatiques
6. De la sécrétion de facteurs suppressifs
Ce privilège qui peut être interprété
comme un moyen de protection des neurones dont les fonctions sont vitales
pour l'organisme, peut néanmoins se retourner contre l'hôte
lorsque le système nerveux est le siège d'une infection,
puisque alors le système nerveux ne peut pas bénéficier
des effets bénéfiques d'une réponse T cytotoxiques
permettant le contrôle de l'infection par la destruction des cellules
infectées.
Le système nerveux semble en effet appliquer la règle «
mieux vaut encore un neurone infecté qu'un neurone mort ».
Si le système nerveux contrôle le fonctionnement du système
immunitaire en son sein, il est aussi manifeste qu'il peut contrôler
le fonctionnement du système immunitaire en périphérie
en particulier en induisant une immunosuppression ou une inflammation
périphérique. Ces perturbations peuvent apparaître
à la suite d'une infection du SN, une blessure, un stress, une
tumeur.
Le contrôle du SN sur le SI est rendu possible par :
1. le partage de récepteurs à neurotransmetteurs par les
cellules immunitaires et neuronales qui sont ainsi sensibles toutes les
deux aux cytokines et aux neurotransmetteurs
2. l'innervation des organes lymphoïdes par des terminaisons qui
délivrent aux cellules immunes des neurotransmetteurs et ou des
cytokines
3. la sécrétion d'hormones par les neurones, véhiculées
par la voie sanguine, qui régulent des fonctions immunes.
I- ACTION DU SYSTEME IMMUNITAIRE
DANS LE SYSTEME NERVEUX CENTRALE
A - Le privilège immun
Le concept de privilège immun est fondé sur les expériences
de greffe dans le SN par Medawar (Medawar 1948). Il a été
formulé pour expliquer pourquoi des greffons allogéniques
n'étaient pas rejetés quand ils étaient introduits
dans le SN, l'œil ou les organes reproducteurs. Les greffons auraient
été protégés de l'attaque des cellules tueuses
par la limitation des échanges entre le SN et le sang et par un
ensemble de mécanismes aboutissant à une mauvaise reconnaissance
des tissus ou à une inactivation des mécanismes d'élimination
immunitaires
Il a été montré par la suite que la réponse
immune au niveau du SN était effectivement particulière.
Elle se caractérise par :
1. Faible expression de CMH et de molécules de co-stimulation sur
les cellules du cerveau ou sur les cellules endothéliales des capillaires
2. Barrière hemato-méningée (qui limite les passages
des cellules du système immunitaire en particulier les lymphocytes
T et B)
3. Cytokines immunosupressives sécrétées par les
cellules gliales (PG ou TGF-b (Transforming
Growth Factor b).
4. Environnement qui favorise les réponses de type Th2
B - La barrière hemato
meningée (Blood Brain Barrier = BBB)
Elle est constituée par les parois des capillaires sanguins qui
irriguent le système nerveux. Elle règle le passage des
cellules immunitaires et des protéines dans le SN. Elle est là
pour théoriquement protéger le système nerveux des
invasions de pathogènes ou de toxines microbiennes. Elle est imperméable
aux protéines grâce à ses jonctions serrées
et la faiblesse du flux transcellulaire.
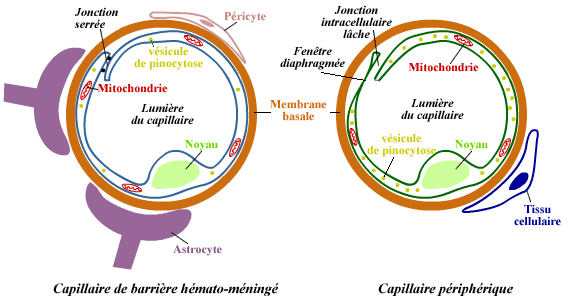
Dans le SN sain, très peu de cellules immunes
passent la BBB. C'est seulement lors d'une inflammation, que certaines
cellules sont capables de s'immiscer au travers. L'inflammation induit
l'expression de molécules d'adhésion (ICAM, VCAM) et de
présentation des antigènes (CMH de classe I et II) qui attirent
les neutrophiles et permettent le passage des monocytes et des lymphocytes
dans le SN inflammé. Le passage des monocytes et des lymphocytes
activés au travers de la BBB s'effectue en trois étapes:
roulement, adhésion, migration. Ces trois étapes mettent
en jeu différentes paires de molécules adhésives.
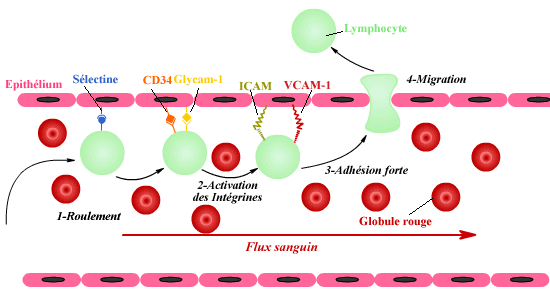
Passage des lymphocytes activés au travers de la BBB.
Les cytokines TNF-a, IL-1
et IFN-g favorisent l'expression de ICAM et
autres intégrines et favorisent l'attraction des lymphocytes et
monocytes dans le SN.
Les lymphocytes T ont du mal à se déplacer dans le parenchyme
du fait de l'absence de canaux lymphatiques, néanmoins il semble
qu'il y ait une préférence pour la matière blanche
et une sélection en faveur des lymphocytes CD8 (Carson et al, 1999).
C - La faible expression des molécucles
de présentation des antigènes (CMH) dans le SN est un phénomène
actif
Un système nerveux sain n'exprime que peu de CMH class I et II.
Les neurones électriquement actifs (vivants) down-régulent
l'expression des molécules de classe I et II sur les cellules gliales
environnantes.
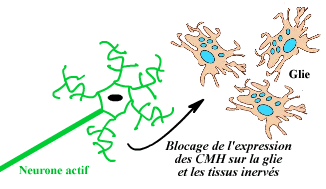
La mort électrique des neurones s'accompagne
de l'arrêt de cette répression. Il y a alors expression des
CMH de classe II sur les gliales environnantes et expression des CMH de
classe I sur les neurones.
La section des terminaisons faciales des nerfs crâniens s'accompagne
d'une réorganisation des synapses et de l'expression de novo des
molécules CMH de classe I et II sur les cellules gliales activées
( Kreutzberg, 1996) et aussi sur les cellules des tissus innervés
(Finsen et al, 1993). Il en est de même lorsque l'activité
électrique est bloquée (traitement à la tetrodotoxine
) (Gendersen et MaeWen, 1994). Si les neurones sont en bon état,
il y a abrogation de l'augmentation de CMH de classe II sur les cellules
gliales environnantes induites par le traitement avec de l'IFN-g.
L'empoisonnement de l'activité électrique des neurones avec
de la tetradotoxine annule cet effet (Neuman et al, 1996).
Les neurones silencieux électriquement expriment les CMH de classe
I et b2-microglobuline en culture hippocampale
dissociées et aussi in vivo sur des moto neurones spinaux (Neumann
et al, 1997, Linda et al., 1998)
Le contrôle de l'expression en surface des CMH pourrait s'effectuer
par transferts ioniques, par l'intermédiaire des signaux transitant
par des molécules d'adhésion, ou des facteurs solubles.
On sait que les neurotransmetteurs ou neuropeptides (norepinephrine, et
VIP (Vaso-active Intestinal Peptide) agissent directement en culture d'astrocytes
pour s'opposer à l'effet de l'interféron qui est de stimuler
l'induction des CMH de classe I (Frohman et al. 1988 a et b). Les neurotrophines
qui peuvent être produites par les neurones (Thoenen et al, 1995,
Lo, 1995) comme le NGF (Nerve Growth Factor) et la NeuroTrophine 3 (NT-3)
"down-régulent" l'expression des molécules de
CMH sur les cultures d'astrocytes (Neumann et al, 1998).
Si le niveau d'expression des CMH est faible dans le parenchyme nerveux
(dans la zone spongieuse du cerveau) , certaines zones en sont riches:
c'est le cas des macrophages dans les espaces perivasculaires, dans les
méninges et les plexus choroïdes qui expriment fortement ces
molécules ce qui en fait des présentatrices potentielles,
en particulier si ces cellules portent le phénotype de cellules
dendritiques matures. La présence de cellules présentatrices
professionnelles dans certaines zones du SN pourrait expliquer que les
greffes introduites dans les plexus choroïdes (qui secrètent
le liquide céphalo-rachidien) ou au niveau des méninges
(enveloppes conjonctives qui séparent le crâne de l’encéphale)
soient rejetées, à la différence de celles qui sont
réalisées dans le parenchyme nerveux.
D - Les cellules présentatrices
d'antigènes:
Parmi les cellules de la glie qui peuvent présenter les antigènes,
les meilleures présentatrices seraient les cellules microgliales
car elles expriment les molécules du CMH de classe II ainsi que
les molécules d'adhésion. Les astrocytes up-régulent
rarement les molécules du CMH de classe II et n'expriment pas de
molécules d'adhésion.
Les réponses de type Th1 sont favorisées par la production
d'IL-12, celles de type Th2 par la production d'IL-4. Les cellules résidentes
ne produisent pas d'IL-4. Par contre, la microglie activée produit
de l'IL-12. Les astrocytes n'en produisent pas mais en inhibent la production
par la microglie activée (Aloi si et la, 1997) .
La microglie activée et les astrocytes agressés produisent
des cytokines (IL-10, TGF-b) et des prostaglandines
qui limitent l'installation d'une réponse Th1.
La microglie activée produit MIP-1a,
plutôt un attracteur de Th1, alors que les astrocytes secrètent
MCP-1 qui serait plutôt un attracteur de Th2.
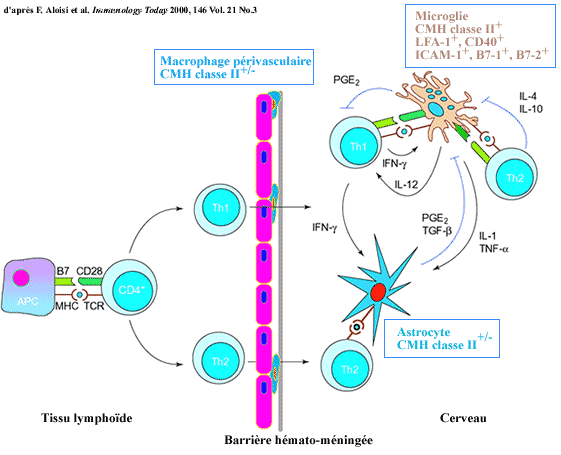
Régulation de la réponse intracérébrale
des cellules T par les CPAs du SNC
Les cellules présentatrices du SN sont donc en
majorité des cellules présentatrices non professionnelles
d'efficacité limitée.
E - Destruction des lymphocytes activés
1 - Présentation par des cellules non
professionnelles induit l'apoptose des lymphocytes :
Les astrocytes et la glie ne sont pas d'efficaces présentatrices
d'antigène qui ne permettent pas l'activation complète des
lymphocytes. Au contraire, elles induisent leur destruction par apoptose.
(Gold et al 1996, Ford et al, 1996)
2 - Fas/Fas ligand: apoptose des cellules T porteuses
de Fas
La molécule Fas est un récepteur de surface appartenant
à la famille des récepteurs au TNF, qui transduit des signaux
de mort lorsqu'il se lie a son ligand (FasL) (Suda et Nagata, 1994, Nagata
et Godstein, 1995)(Bellgrau et al, 1995). Les cellules du cerveau (astrocytes
et peut être neurones) peuvent exprimer FasL, (Bechman et al, 1999).
Les lymphocytes activés même sans spécificité
antigénique pour les constituants du cerveau passent la barrière
(Hickey et al, 1991). Il a été proposé que les lymphocytes
activés, porteurs de Fas, soient éliminés par apoptose
en rencontrant le ligand de Fas (Ohmori et al, 1992). Ce mécanisme
permettrait ainsi de réduire l'action des lymphocytes activés
qui passent la barrière.
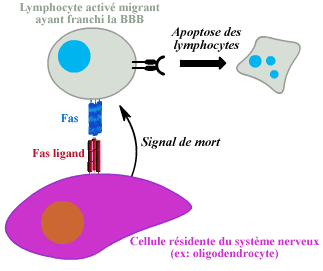
Elimination des lymphocytes activés par intercation Fas/Fas-ligand
Ce mécanisme pourrait aussi être impliqué
dans la destruction des oligodendroyctes lors des atteintes de sclérose
en plaques puisque ces cellules présentes dans les plaques de démyélination
expriment Fas (D'Souza et al, 1996). Néanmoins, le processus de
mort cellulaire générée dans les oligodendrocytes
serait différent de celui observé dans les lymphocytes puisqu'il
n'aboutirait pas à la fragmentation de l'ADN (non marquées
par la technique TUNEL).
F - Cytokines immunodépressives
Les céramides, le TGF-b présents
dans les extraits de SN peuvent supprimer l'activation des lymphocytes
T (Irani, 1997).
Les facteurs solubles immunosuppresseurs comme la VIP, l'a-Melanocyte
Stimulating Hormone (a-MSH), le Calcitonin
Gene Related Peptide (CGRP) sont des inhibiteurs d'une réponse
de type Th1 (Taylor et al, 1994).
G - Echappement du système
Malgré les mécanismes de protection mis en place dans le
SN, une certaine réponse immune peut se mettre en place dans le
SN infecté. Son ampleur est moindre qu'en périphérie
et elle se caractérise par une réponse de type Th2 qui n'aboutit
pas à la clairance de l'infection. L'absence de contrôle
de l'infection peut alors induire soit la mort de l'hôte, soit l'installation
d'une infection chronique ou latente. Ce qui peut expliquer que le matériel
génétique de si nombreux virus soient communément
retrouvés dans le système nerveux adulte sain.
Le privilège immun peut être complètement
annulé lors de certaines infections du système nerveux.
Il s'agit des infections qui re-larguent des antigènes viraux dans
le liquide céphalorachidien ou qui infectent les méninges.
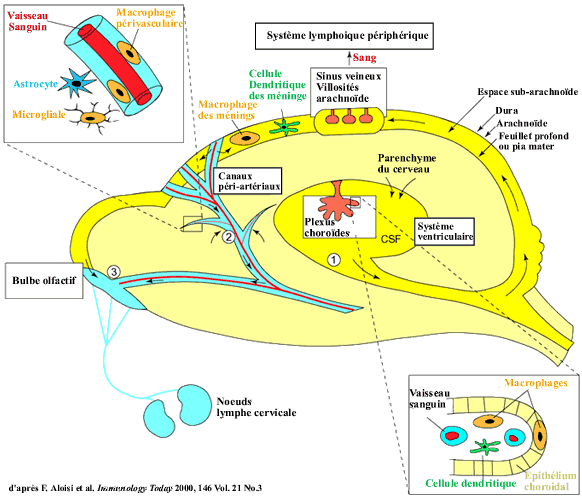
Les antigènes sont visibles dans le cerveau lorsque:
l'Ag est capturé par des CPA professionnelles ; lors de l'infection
des méninges, des cellules endothéliales (Macrophage et
dendritique) ; lors d'infection en périphérie ; lors d'un
passage d'un virus, d'un corps apoptotique ou d'un antigène dans
le LCR
Dans ce cas les antigènes viraux sont capturés
par les cellules présentatrices professionnelles des méninges
ou des plexus choroïdes (cellules dendritiques ou macrophages perivasculaires)
ou drainés par le liquide céphalorachidien vers les ganglions
cervicaux (Aloisi et al, 2000) (Czerr et Knopf, 1992). La présentation
par les dendritiques ( Fisher, 2000, Carson, 1999) permet l'installation
d'une réponse immune classique sans biais Th2, qui peut aboutir
à la clairance des cellules infectées, soit pas cytotoxicité
(à condition que les cellules infectées expriment des molécules
de CMH de classe I fonctionnelles), soit par la sécrétion
de substances antivirales comme l'IFN-g.
H - Illustration : pathogénicité
de deux souches neurotropes de virus de la rage
Voir articles Galelli et al, 2000, Camelo et al, 2000, Baloul et al. 2002.
La pathogénicité de la souche de rage dépend de sa
capacité à induire une réponse immune. L'infection
par la souche apathogène présente des caractéristiques
qui lèvent le privilège immun. La réponse immune
déclenchée induit la clairance de l'infection. Même
si l'animal reste paralysé, il survit mais le virus ne boucle pas
son cycle. Dans le cas de l'infection par le virus pathogène, le
privilège immun du SN est maintenu. Le virus n'induit pas de réponse
immunitaire spécifique. Le virus boucle son cycle. L'animal meurt.
II- ACTION DU SYSTEME NERVEUX SUR LE SYSTEME IMMUNITAIRE
Les lésions du cerveau induisent une immunosuppression.
Ainsi des lésions de l'hypothalamus réduisent la cellularité
du thymus et de la rate, et diminuent aussi la réponse à
la conA (4 jours après la lésion) (Cross et al, 1980, Rozman
et al, 1985,) il en est de même de lésions dans l'amygdale
centrale ou la formation réticulaire latérale (petrovicky
et al, 1994).
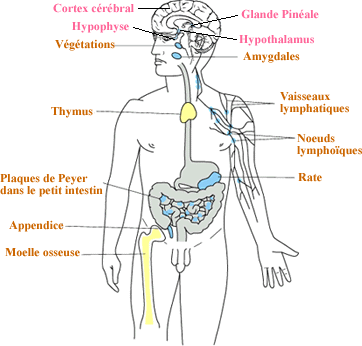
Système immunitaire et système nerveux communiquent
Néanmoins toutes les lésions n'induisent
pas l'immunosuppression ainsi on n'observe pas d'immunosuppression si
les lésions touchent l'hippocampe, le raphé. Des lésions
dans ces régions du cerveau au contraire stimulent la réponse
aux mitogènes. Les hormones corticostéroïdes peuvent
jouer un rôle de contrôle (Rozman et al, 1985) mais pas toujours
(Perry et Lodmell, 1990).
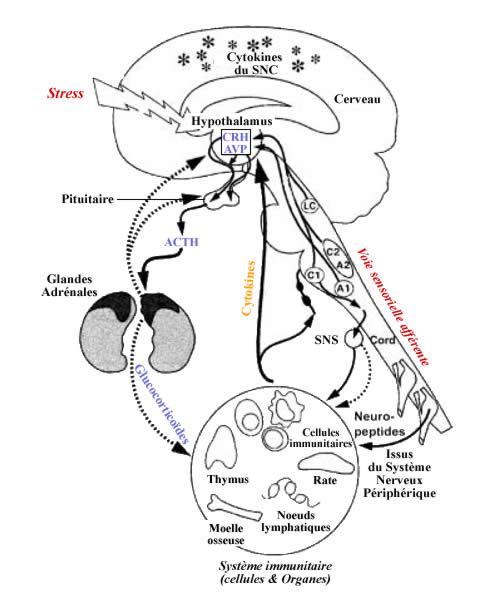
Voie humorale au travers de l'axe Hypothalamus-Pituiaire-Adrénergique
(HPA)
(CRH : Coticotropine Releasing Hormone, ACTH : Adrenecorticotropic Hormone)
Le contrôle de la réponse immunitaire peut
aussi s'effectuer au travers de l'innervation des organes lymphoïdes
périphériques. Les terminaisons nerveuses véhiculent
des neuromédiateurs qui peuvent moduler le fonctionnement des cellules
du système immunitaire. Parmi les neuromédiateurs actifs,
on peut citer les catécholamines et plus particulièrement
la norepinéphrine. Les cellules du système immunitaire expriment
des récepteurs de ces neuromédiateurs.
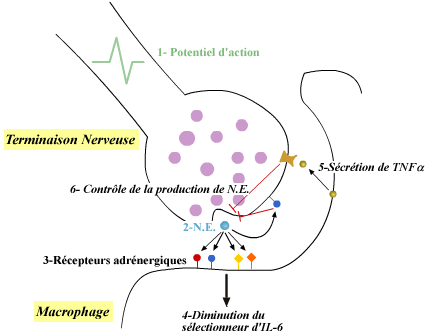
Interaction entre une terminaison nerveuse et un macrophage
de la rate
Sous l'action d'un Potentiel
d'action(1), la norepinephrine (N.E.) est excrétée
par la terminaison nerveuse à proximité du macrophage(2),
et se lie aux récepteurs adrénergiques du macrophage(3).
La liaison de la N.E. à la membrane du macrophage diminue
le selectionneur d'IL-6(4). En retour, le macrophage, par sécrétion
de TNF a(5), peut contrôler la
production par la terminaison nerveuse de N.E.(6).
|
Une régionalisation du cerveau en ce qui concerne
l'action des cytokines n'est pas exclue (patterson et al, 1993). Ainsi
les mastocytes sont présents en plus grand nombre dans le thalamus
que dans d'autres parties du cerveau et la susceptibilité des astrocytes
et des microglies aux cytokines varie en fonction de leur origine (ex:
TGF-b induit la croissance des astrocytes lorsque
ceux ci sont issus du brainstem mais pas de la forebrain, Johns et al
1992)
Les patients hémiplégiques a la suite de lésion unilatérales
du CNS ne vont pas développer d'inflammation dans les membres paralysés.
Le privilège immun du cerveau s'étend en dehors du CNS :
Les tumeurs du cerveau s'accompagnent de sécrétion de TGF-b
qui réduit la réponse immune en périphérie.
L'infection de certains neurones par le virus pseudo-rabies (virus de
la Maladie d' Aujezsky), induit une inflammation de la vessie chez le
rat (Jasmin et al, 1998). Cette inflammation ne résulte pas de
l'infection de la vessie ni de celles des nerfs afférents. La section
des voies sympathiques de la vessie protége l'animal infecté
de l'inflammation de l'organe.
Illustration: l'immunosupression induite par le virus
de la rage (Camelo et al, 2000), inflammation de la vessie lors de l'infection
par le virus de la maladie d'Aujeski (Jasmin et al, 1998).
BIBLIOGRAPHIE:
MHC Class I et II sur neurones et microglie
Corriveau RA et al. 1998. Regulation of class I MHC gene expression in
the developing and mature CNS by neural activity. Neuron 21: 505-520
Finsen BR et al.. 1993. Induction of microglial immunomolecules by anterogradely
degenerating mossy fibers in the rat hippocampal formation. J Chem Neuronat
6 : 273-275
Frohman et al. 1988a. Norepinephrine inhibits g-interferon
induced MHC class II in cultured astrocytes via p2 adrenergic signal transduction
mechanisms PNAS 85 : 1292-1296
Frohman et al. 1988b. Vasoactive intestinal polypeptide inhibits the expression
of MHC class II antigens on astrocytes. J Neurol. Sci. 88: 339-346.
Gundersen K et al. 1994. Nerve-evoked electrical activity regulates molecules
and cells with immunological function in rat muscle tissue. Eur J Neurosc
6 : 1113-1118
Kreutzberg GW .1996. Microglia: a sensor for pathological events in the
CNS. Trends Neurosc, 19: 312-318
Joly E and Oldstone 1991. Viral persistence in neurones explained by lack
of major histocompatibility class I expression. Science 253: 1283-1285.
Linda H et al. 1998. Expression of MHC class I and b2-microglobulin
in rat spinal motoneurons. Regulatory influences of IFN-g
and axotomy. Exp Neurol150: 282-295
Lo DC. 1995. Neurotrophic factors and synaptic plasticity. Neuron. 15:
979-981.
NeumannHet al. 1995. Induction of MHC class I genes in neurons. Science
269: 549-552
Neumann H et al. 1996. Neuronal control of MHC class II inductibility
in rat astrocytes and microglia. Eur J Neurosci. 8 : 2582-2590
Neumann H et al. 1997a. MHC class I gene expression in single neurons
of the central nervous system: Differential regulation by interferon-g
and tumor necrosis factor-a. J exp Med 185:
305-316
Neumann H et al. 1997b. Interferon-g gene expression
in sensory neurons. Evidence for autocrine gene regulation. J. exp merl.
186: 2023-2031.
Neumann H et al. 1998. Neurotrophins inhibit class II inductibility of
microglia: involvment of the p75 receptor. PNAS 95: 5779-5784.
Tchélingérian et al. 1993. Localization of TNF-a
and IL-1a immunoreactivities in striatal neurons
after surgical injury to the hippocampus. Neuron. 10: 213-224.
Thoenen et al. 1995. Neurotrophins and neuronal plasticity. Science 270:
593-598
Apoptose des lymphocytes T
GoldR et al, 1996. Antigen presentation by astrocytes primes rat T lymphocytes
for apoptotic cell death. Brain.119: 651-659
Ford et al, 1996. Microglia induce CD4 T lymphocyte final effector function
and death. J exp Med 184: 1737-1745.
Bellgrau et al. 1995. A role of CD95 ligand in preventing graft rejection.
Nature. 377: 630- 632.
Griffith et al, 1995. Fas ligand induced apoptosis as a mechanism of immune
privilege. Science 270. 1189-1192.
Nagata S and Goldstein P. 1995. The Fas death factor. Science 267: 1449-56.
Suda T and Nagata S. 1994. Purification and characterisation of the fas-fasL
that induces apoptosis. J exp Med. 179:873-879.
Aggarwal et al, 1995. Fas antigen signals proliferation of normal human
diploid fibroblasts and its mechanism is different from TNF receptor.
FEBS letter: 364:5-8.
D 'Souza et al. 1996. Multiple sclerosis : Fas signaling in oligodendrocyte
cen death. J exp Med184: 2361-2370.
Bechman I I999. FasL (CD95L, Apo1L) is expressed in the normal rat and
human brain. Glia 27: 62-74.
Hickey et al. 1991. T-lymphocyte entry into the central nervous system.
J Neurosc. Res 28 : 254-260.
Ohmori et al. 1992. In situ demonstration of proliferating cells in the
rat central nervous system during experimental autoimmune encephalomyelitis:
evidence suggesting that most inflitrating lymphocytes do not proliferate
in the target organ. Lab Invest 66: 54-62.
Facteurs suppresseurs
Irani et al, 1997. Regulation of brain-derived T cells during acute central
nervous system inflammation. J Immunol. 158: 2318-26.
Taylor et al. 1994. Identification of alpha melanocyte stimulating hormone
suppresses antigen stimulated T cell production of INF-g.
Neuroimmunomodulation. 1:188-194.
Historique du privilège immun
Medawar P 1948. Immunity to homologous grafted skin. The fate of skin
homografts transplanted to the brain, to subcutaneous tissue and to the
anterior chamber of the eye. Br. J Exp Pathol. 29:58-69
Streilein JW 1995. Unraveling immune privilege. Science. 270: 1158-1159.
Jasmin et al. 1998. Activation of CNS circuits producing a neurogenic
cystitis: evidence for centrally induced peripheral inflammation. J Neurosci.
18: 10016-29.
Cserr H and Knopf P. 1992. Cervical lymphatics, the blood brain barrier
and the immunoreactivity of the brain: a new view. Immunol Today. 13:507-512.
Cellules présentatrices dans le SN
Fisher H-G et al. 2000. Phenotype an funcitons of brain dendritic cells
emerging during chronic infection of mice with Toxoplasmagondii. J Immunol.
164: 4826-4834.
Carson MJ et al. 1999. Disproportionate recruitment of CD8+ T cells into
the central nervous system by professional antigen presenting cells. Am
J Pathol. 154: 481-494.
Aloisi F. 2000. Regulation of T-cell responses by CNS antigen-presenting
cells: different roles for microglia and astrocytes. Immunol Today. 21
: 141-147
Aloisi et al, 1997. Il-12 production by central nervous system microglia
is inhibited by astrocytes. J Immunol. 159: 1344-1351.
Barriere Hemato-méningee
Tous les articles du numéro 5 de Journal of NeuroVirology 1999
Virus de la rage
Galelli et al. 2000. Abortive rabies virus central nervous infection is
controlled by T lymphocyte local recruitment and induction of apoptosis.
J Neurovirol. 6: 359-372.
Camelo et al, 2000. Absence of the P55Kd TNF-a
receptor promotes survival in rabies virus acute encephalitis. J Neuro
Virol.
Camelo et al. 2000. Selective role for the P55 Kd TNF-a
receptor in immune unresponsiveness induced by an acute viral encephalitis.
J Neuroimmunol. 2000
Irwin et al. 1999. Basis of rabies virus neurovirulence in mice : expression
of MHC class I and class II mRNAs. J neuroVirol. 5: 485-494.
Peny and Lodmell. 1990. Murine susceptibility to street rabies virus is
unrelated to induction of host lymphoid depletion. J Immunol. 144: 3552-3557.
|