PATHOGENESE DES INFECTIONS VIRALES NEUROTROPES
d'après le cours de Michel BRAHIC, Unité
des virus lents, Institut Pasteur
INTRODUCTION
Lors d'une infection virale, la disparition des symptômes
et la régression de la maladie ne s'accompagne pas forcément
de l'élimination complète de l'agent infectieux. En effet,
dans certains cas, le génome viral reste présent dans l'organisme
et peut donner lieu ultérieurement à une maladie chronique
évoluant parfois progressivement durant toute la vie de l'individu.
Les infections virales persistantes représentent un problème
majeur de santé publique. Elles sont impliquées dans de
nombreuses pathologies humaines qui vont de maladies bénignes comme
des infections herpétiques à des syndromes graves dont l'exemple
le plus tristement célèbre est celui du SIDA, mais aussi
des hépatites B ou C.
Virus |
Famille |
Cellules et tissus associés
à l'infection persistante |
Maladie |
| Virus herpès simplex (HSV1 et 2) |
Herpèsvirus |
Neurones |
Herpès labial et génital, encéphalite,
kératites |
Virus de la varicelle
|
Herpèsvirus |
Neurones |
Varicelle-Zona |
| Cytomégalovirus (CMV) |
Herpèsvirus |
Lymphocytes, monocytes, rein, glandes salivaires |
Pneumonie, encéphalite, rétinite,
colite |
| Virus d'Epstein Barr |
Herpèsvirus |
Lymphocyte B, cellules épithéliales
du pharynx |
Mononucléose infectieuse, lymphome
de Burkitt, cancer du nasopharynx |
| Virus JC |
Polyomavirus |
Rein, système nerveux central (SNC) |
Leucoencéphalite multifocale progressive
(LMP) |
| Virus de l'hépatite B |
Hépadnavirus |
Hépatocytes, pancréas (?), mœlle
osseuse (?) |
Hépatite chronique, cancer primitif
du foie |
| Virus du papillome |
Papillomavirus |
Peau |
Papillomes, carcinomes |
| Virus de la rougeole |
Paramyxovirus |
Neurones, cellules gliales |
Panencéphalite sclérosante subaigüe
(SSPE), MIBE |
| HIV 1 et 2 |
Rétrovirus |
Lymphocytes, monocytes, microglie |
Syndrome d'immunodéficience humaine
(SIDA) |
| Virus LymphoTropes Humain (HTLV) |
Rétrovirus |
Lymphocytes |
Leucémie (ATL), Paraparésie
Spastique Tropicale (TSP) |
Maladies induites par des virus persistant chez
l'homme (d'après R. Ahmed, 1990)
La persistance virale est un phénomène
complexe et représente un domaine d'étude important en virologie.
Les infections virales persistantes ont été divisées
schématiquement en deux types: les infections chroniques productives
et les infections latentes. Lors d'une infection chronique productive,
il y aproduction permanente de particules virales infectieuses. C'est
le cas par exemple de l'infection par le virus de l'hépatite B
(Marion et Robinson 1983). Par opposition, lors d'une infection latente,
seul le génome viral est présent dans les cellules infectées.
La production de particules virales n'apparaît qu'épisodiquement
lors des périodes de réactivation. Un exemple de ce type
d'infection chez l'homme est l'infection par les virus de l'herpes (Roizman
et Sears 1987; Stevens 1989). Cette classification s'avère cependant
un peu trop schématique étant donnée la complexité
des mécanismes impliqués dans la persistance virale. En
effet, l’infection peut être chronique ou latente suivant
le type cellulaire infecté. Le virus de l'hépatite B donne
une infection productive dans les hépatocytes alors qu'elle est
latente dans les lymphocytes (Korba, Cote et al. 1988). Le virus Epstein-Barr
(EBV) persiste de façon latente dans les lymphocytes B mais on
observe également une infection productive des cellules épithéliales
du pharynx (Korba, Cote et al.1988; Rickinson 1988; Yao, Rickinson et
al. 1985). L'infection productive ou latente peut également dépendre
de l'état d'activation des cellules. C'est le cas par exemple de
l'infection des cellules par le virus de l'immunodéficience humaine
(HIV) pour lequel l'infection est productive dans les macrophages et les
cellules T CD4+ activées, alors qu'elle est latente dans les cellules
au repos. Ces exemples illustrent bien la difficulté de définir
de façon précise la nature d'une infection persistante.
L’établissement et le maintien de la persistance
d'un virus dans un organisme est la résultante de nombreux mécanismes.
Pour persister, plusieurs conditions sont nécessaires. De nombreuses
stratégies permettant aux virus de remplir ces conditions ont été
décrites. Trois aspects seront abordés dans ce chapitre:
1- les principaux mécanismes qui permettent à un
virus d'établir une infection persistante
2- les sites d'infections persistantes virales avec en particulier un
site privilégié: le système nerveux central
3- les gènes viraux qui contrôlent la persistance.
Ce dernier aspect est évidemment complexe et très
vaste étant donné la diversité des mécanismes
impliqués dans la persistance virale. Nous nous limiterons donc
à la description d'un exemple précis, l'infection par le
Virus de la ChorioMénigite Lymphocytaire (LCMV) pour lesquel il
a été établi de façon clair un lien entre
un gène et la capacité d'un virus à persister.
I- LES MECANISMES DE PERSISTANCE
VIRALES
Pour persister, deux conditions majeures sont nécessaires.
Tout d'abord, le virus ne doit pas lyser toutes les cellules infectées
et son potentiel cytolytique doit être régulé. Ensuite,
le virus doit échapper à la réponse immunitaire de
l'hôte. Pour cela, les virus ont développé de nombreuses
stratégies, dont voici quelques exemples:
A - Régulation du potentiel lytique
Pour qu'un virus persiste dans un organisme, la première
condition requise est la survie d'un certain nombre de cellules infectées.
Certains virus se répliquent sans tuer la cellule infectée
et ont donc une facilité particulière à établir
un état de persistance. C'est le cas par exemple de certains rétrovirus
et du virus LCMV. Le problème est différent pour des virus
qui ont un potentiel cytolytique ou qui, lors du cycle viral, perturbent
de façon importante le métabolisme cellulaire et donc l'intégrité
de la cellule. Lors d'une infection persistante, ces virus doivent réguler
leur potentiel lytique afin de limiter le taux de mortalité des
cellules infectées. Différentes stratégies ont été
développées par les virus afin de limiter voire d'éliminer
leur potentiel lytique.
1 - Restriction de l'expression de gènes
viraux
Un exemple de régulation du potentiel lytique par restriction de
l'expression de gènes viraux est l'infection des neurones par le
virus de l'herpes simplex 1 (HSV-1). Après infection des tissus
périphériques (muqueuses), le virus remonte par voie axonale
rétrograde et une infection persistante latente s'établit
dans les neurones, principalement les neurones des ganglions sensoriels.
Le virus HSV-l est un virus lytique. La protéine virale VP16 est
associée aux virions infectieux. Lors de l'infection productive,
la protéine VP16 interagit avec des facteurs transcriptionnels
comme le facteur Oct-l et induit ainsi la transcription des gènes
très précoces. Les produits des gènes très
précoces (ICPO, ICP4 et ICP27) vont trans-activer les gènes
précoces et les gènes tardifs responsables de la lyse cellulaire.
L'établissement de la latenœ dans les neurones est liée
à une absence d'expression des gènes très précoces
et donc une répression de l'activité cytolytique. Des données
indiquent que la protéine VP16 n'est pas fonctionnelle dans les
neurones. Deux hypothèses ont été avancées.
D'une part, des facteurs cellulaires nécessaires à la fonction
de la protéine VP16 seraient absents dans les neurones. En effet,
He et al. ont montré que des neurones du système nerveux
périphérique n'expriment pas le facteur Oct-1 (He, Treacy
et al. 1989). D'autre part, il est possible que la fonction de la protéine
VP16 soit inhibée par des facteurs neuronaux qui pourraient par
exemple entrer en compétition pour la fixation sur le promoteur
des gènes très précoces. Ainsi, lors d'une infection
latente dans les neurones, un très faible nombre de transcrits
du virus HSV-1 sont détectés. Les seuls gènes viraux
exprimés sont les gènes codant poux les transcrits LATs
(Latency-Associated Transcripts). Ce sont de petits ARNs antisens complémentaires
de l'extrémité 3' de l'ARNm correspondant au gène
très précoce ICPO (Stevens, Wagner et al. 1987). La répression
des ARNm ICPO par les transcrits LATs avait été proposé
comme mécanisme pouvant expliquer le maintien de la latence. Cependant,
des virus mutants n'exprimant pas les transcrits LATs sont capables de
produire une infection latente dans les neurones (Sedarati, Izumi et al.
1989). Les transcrits LATs ne semblent donc pas jouer de rôle dans
l'établissement et le maintien de la latence. Ces molécules
pourraient être impliquées dans la réactivation virale.
La réactivation de la réplication du virus HSV-1 peut être
induite par des stimuli externes tels que des stress physiques ou émotionnels.
La réactivation est liée à l'expression des gènes
très précoces activée en particulier par le produit
du gène ICPO (Garcia- Blanco et Cullen 1991).
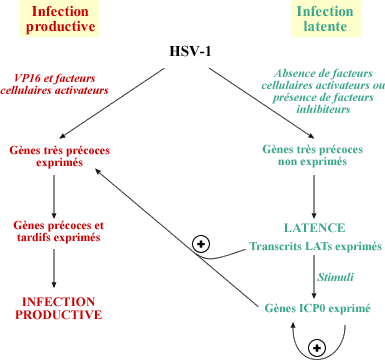
Régulation de la latence du virus HSV-1
L'expression des gènes très
précoces est la première étapes de l'infection
productive. Celle-ci requiert la fonction de la protéine
VP16 en association avec des facteurs cellulaires. Dans les neurones,
la protéines VP16 n'est pas fonctionnelle et la latence
peut ainsi être établie. Durant cette phase, seuls
les transcrits LATs sont détectés. Ceux-ci ne sont
pas nécessaires au maintien de la latence mais sont probablement
impliqué dans la réactivation de la réplication
virales. Certain stimuli externes peuvent induire l'expression
du gène ICP0. Le produit de ce gène active sa propre
transcription ainsi que celle des autres gènes très
précoces, conduisant à une infection productive.
(modifié d'après Garcia-Blanco et al., 1991)
|
2 - Génération de variants viraux
L'établissement et le maintien de la persistance virale peut faire
appel à l'apparition de variants qui ont perdu leur pouvoir lytique.
Un exemple de l'apparition de variants viraux lors d'une infection persistante
est le cas du virus de la rougeole. Ce virus est responsable, chez l'enfant,
d'un exanthème aigu peu étendu. Dans de rares cas, il peut
donner lieu à une maladie neurodégénérative
du système nerveux central (SNC), la panencéphalite sclérosante
subaiguë (SSPE). Celle ci est dut à une infection persistante
des neurones et des cellules gliales du SNC par des variants viraux. Cette
maladie est caractérisée par l'absence de production de
particules virales infectieuses. L'étude de matériel isolé
à partir du SNC de patients atteints de SSPE a permis la mise en
évidence de variants viraux défectifs, incapables de s'assembler
et de produire un cycle lytique. Des mutations dans plusieurs gènes
viraux ont été décrites. En particulier, il semble
qu'une accumulation de mutations dans le gène codant pour la protéine
de matrice (M) soit responsable d'une altération voire d'une absence
de l'expression de cette protéine. Des mutations dans d'autres
parties du génome ont également été décrites,
notamment dans les gènes codant pour la protéine de fusion
(F), pour l'hémagglutinine (H), ou pour la phosphoprotéine
(P). Ces protéines sont nécessaires au cycle lytique et
une modification de l'expression de ces protéines, en particulier
de la protéine M, pourrait expliquer l'absence de lyse cellulaire
(Cattaneo et Billeter 1992; Hummel, Vanchiere et al. 1994).
B - Echappement au système immunitaire
Un aspect fondamental de la persistance virale est l'échappement
au système immunitaire. Les virus ont développé diverses
stratégies pour pouvoir persister au sein d'un organisme et échapper
à l'élimination par le système immunitaire de l'hôte.
1 - Les effecteurs spécifiques contrôlant
l'infection virale
Les deux principaux effecteurs contrôlant l'infection virale de
façon spécifique sont les anticorps et les cellules T. Les
anticorps peuvent reconnaître à la fois les particules virales
libres et les cellules infectées. Les anticorps contrôlent
l'infection en neutralisant le virus libre ou en tuant les cellules infectées.
La lyse des cellules infectées se fait par la voie de cytotoxicité
médiée par le complément ou par la voie de cytotoxicité
cellulaire dépendante des anticorps (ADCC). Les anticorps responsables
de la neutralisation virale ou de la lyse des cellules infectées
sont dirigés contre des protéines structurales externes
telles que les glycoprotéines d'enveloppe ou les protéines
externes de capside.
Les lymphocytes T ont une action uniquement sur les cellules infectées
et non sur le virus libre. Ils ne reconnaissent pas des protéines
virales seules mais des peptides viraux présents à la surface
des cellules infectées en association avec les antigènes
du complexe majeur d'histocompatibilité (CMH). Les peptides viraux
reconnus proviennent à la fois des protéines structurales
et des protéines internes non structurales. L'interaction cellule
T - cellule infectée fait intervenir le récepteur cellulaire
T (TCR), ainsi que d'autres molécules présentes à
la surface des cellules T telles que les molécules CD4 ou CD8 et
d'autres molécules d'adhésion. Les lymphocytes T agissent
sur les cellules infectées soit par cytolyse directe, soit par
relargage de lymphokines. Les cellules T CD8+ produisent des cytokines,
en particulier les lymphokines à activité antivirale comme
l'interféron g (IFNg)
et le TNFa, mais la fonction essentielle des
lymphocytes T CD8+ est la lyse des cellules infectées. Les lymphocytes
cytotoxiques (CTLs) CD8+ reconnaissent les cellules exprimant l'antigène
viral en association avec les molécules de classe I du CMH alors
que les lymphocytes T CD4+ reconnaissent l'antigène en association
avec les molécules de classe II du CMH. Les cellules T CD4+ ont
plutôt une fonction immunorégulatrice et sont communément
appelées T auxiliaires ou T "helper" (TH). Il existe
deux types de lymphocytes T CD4+, les TH1 et les TH2. Ceux-ci diffèrent
par la nature des lymphokines qu'ils produisent et donc par leur mode
d'action au sein du système immunitaire. Ainsi, les lymphocytes
TH1 produisent entre autres de l'interleukine-2 (IL-2), de l'IFNg
et du TNFa. et sont majoritairement impliqués
dans le développement de l'hypersensibilité retardée
(DTH) et l'activation des macrophages. Les lymphocytes TH2 secrètent
essentiellement de l'IL-4, IL-5, IL-6 et IL-10s et contrôlent plutôt
la production d'anticorps par les cellules B.
2 - Les moyens d'échappement au système
immunitaire
Comme nous venons de le voir, plusieurs effecteurs du système immunitaire
peuvent intervenir lors d'une infection virale. L'échappement à
la réponse immunitaire est donc le plus souvent le résultat
d'une combinaison de stratégies utilisées par le virus .
Effecteurs |
Cibles |
Moyen d'échappement |
Exemples |
| Anticorps neutralisants |
Virus libre |
-Variation antigénique :
au niveau des glycoprotéines d'enveloppe ou des résidus
exposés à la surface de la capside
-Anticorps bloquants :
compétition avec des anticorps neutralisants |
Lentivirus, FMDV |
| Cytotoxicité des anticorps médiée
par le complément ou Cytotoxicité Cellulaire Dépendante
des Anticorps (ADCC) |
Cellules infectées |
-Restriction de l'expression des protéines
virales à la surface cellulaire
-Variation antigénique dans les protéines
eprimées à la surface cellulaire |
Lentivirus |
| Cellule T |
Cellules infectées |
-Restriction de l'expression des protéines
virales internes et externe |
HIV |
| -Supression de l'expression des molécules
de classe I du CMH |
Adénovirus |
| -Réduction de l'expression de protéines
cellulaires telles que les molécules d'adhésion LFA-3
et ICAM-1 |
EBV dans les lymphomes de Burkitt |
Principaux mécanismes d'échappement
au système immunitaire lors d'une infection persistante
(d'apès R. Ahmed et J.G. Stevens, 1990) |
2-1 Variation antigénique
La variation antigénique est un moyen efficace pour échapper
aux anticorps neutralisants. L'apparition de mutations correspondant
à des sites majeurs de neutralisation permet l'échappement
du virus à la réponse humorale. Les principaux exemples
de virus capables d'accumuler des mutations d'une génération
à l'autre sont les virus à ARN (Holland, De La Torre et
al. 1991; Holland, Spindler et al. 1982). C'est le cas de nombreux lentivirus,
comme le virus Visna (Clements, Gdovin et al. 1988; Narayan, Zink et
al. 1988), le virus HIV, mais aussi certains picomavirus comme le virus
de la fièvre aphteuse (FMDV) (Mateu, Martinez et al. 1989; Parry,
Fox et al. 1990).
2-2 Génération d'anticorps non neutralisants
La présence d'un excès d'anticorps non neutralisants peut
permettre au virus d'échapper aux anticorps neutralisants. En
effet, la fixation d'anticorps non neutralisants sur la particule virale
peut empêcher la fixation des anticorps neutralisants, soit par
compétition directe pour un même site de fixation, soit
par induction d'un changement conformationnel du virion masquant ainsi
l'épitope normalement reconnu par l'anticorps neutralisant (Oldstone
1984).
Le groupe d’A. Flamand a montré que, dans le cas du virus
de la rage, environ 15% des anticorps anti-glycopotéine ne sont
pas neutralisants. Ces anticorps reconnaissent en fait la configuration
adoptée par la glycoprotéine dans des conditions de pH
acide. Ainsi, à pH neutre, ces anticorps ne sont pas neutralisants
car un nombre insuffisant d'anticorps sont fixées sur les particules
virales. En augmentant le temps ou la température d'incubation
avec les anticorps, le nombre d'immunoglobulines fixées augmente
et la neutralisation peut ainsi être induite. Ceci confirme que,
dans le cas du virus de la rage, la neutralisation nécessite
la fixation d'un grand nombre d'anticorps sur le virus (plus de 200
IgG par virion) (Flamand, Raux et al. 1993;
Raux, Coulon et al. 1995).
2-3 Génération de particules interférentes
défectives
Les particules interférentes défectives, ou DI, sont des
particules qui possèdent un génome incomplet. Elles sont
caractérisées par leur incapacité à se répliquer
sans complémentation par le virus sauvage et par leur interférence
avec la multiplication du virus sauvage. Les particules DI apparaissent
au cours des cycles de réplication de nombreux virus tels que
le virus de la grippe, le poliovirus, le virus de la stomatite vésiculeuse
(VSV), le virus de la rougeole, le virus de l'hépatite B (Barrett
et Dimmock 1986). Ces particules peuvent former des complexes avec des
anticorps neutralisants et limiter par compétition la neutralisation
du virus sauvage. Il est probable que les particules DI jouent un rôle
important dans l'établissement de la persistance virale (Huang
et Baltimore 1970).
2-4 Restriction de l'expression des protéines
virales
Dans plusieurs cas d'infections virales persistantes, il apparaît
une diminution de l'expression des glycoprotéines virales à
la surface membranaire de la cellule infectée. Ainsi, les neurones
infectés par le virus HSV ne présentent pas de glycoprotéine
membranaire à leur surface et ne sont donc pas reconnus par les
anticorps qui pourraient être présents dans le liquide
céphalorachidien (LCR) (Stevens 1989). La diminution d'expression
des glycoprotéines lors d'infections persistantes a été
décrite pour d'autres virus tels que les arénavirus, les
paramyxovirus, les rétrovirus et les rhabdovirus.
Le mécanisme décrit ci-dessus concerne uniquement les
protéines structurales. Comme nous l'avons vu, le système
immunitaire est capable de reconnaître également des peptides
issus de n'importe quelle protéine virale et en particulier des
protéines internes non structurales. Ce mécanisme fait
appel à la présentation des peptides par les molécules
de classe I du CMH, les cellules infectées étant ensuite
reconnues par les cellules T CD8+. Afin d'échapper à cette
réponse immunitaire, les virus doivent limiter leur synthèse
protéique. Un des moyens particulièrement efficace est
l'intégration du génome viral au génome de l'hôte.
Ceci est le cas des rétrovirus tels que le virus HIV ou le virus
T lymphotrope humain de type 1 (HTLV-1). Ces virus sont composés
d'une molécule d'ARN simple brin qui est rétrotranscrite
en ADN double brin (provirus) et intégrée dans le génome
de l'hôte. Une fois intégrés, les pro virus sont
stables et se répliquent avec l'ADN cellulaire. Dans le cas du
virus HTLV-1, l'intégration est suivie d'un état de latence
caractérisé par une absence d'expression. Le virus est
ainsi à l'abri de la réponse immunitaire et les périodes
d'incubation peuvent être très longues (jusqu'à
50 ans lors des infections par le virus HTLV-1). L'infection par le
virus RTLV-1 demeure asymptomatique dans 95% des cas.
2-5 Réduction de l'expression de molécules
cellulaires
Certains virus sont capable d'induire une régulation négative
de l'expression des molécules de classe I du CMH à la
surface cellulaire, ce qui est un moyen efficace d'empêcher la
reconnaissance des cellules infectées par les cellules T cytotoxiques
CD8+ (Joly, Mucke et al. 1991b). Un exemple bien étudié
est celui des adénovirus. Plusieurs mécanismes de régulation
négative de l'expression des molécules de classe I du
CMH par les adénovirus ont été décrits.
D'une part, la protéine virale E3 de l'adénovirus humain
de type 2 formerait des complexes avec les molécules de classe
I du CMH, empêchant ainsi le transport de ces molécules
à la surface cellulaire (Andersson, Paabo et al. 1985; Burgert,
Maryanski et al. 1987). D'autre part, l'adénovirus de type 12
inhiberait la synthèse protéique des molécules
de classe I du CMH en agissant au niveau de la transcription des ARNm
ou de leur transport à l'extérieur du noyau (Bernards,
Schrier et al. 1983; Paabo, Nilsson et al. 1986).
L'inhibition de la présentation des antigènes par les
molécules de classe I du CMH a également été
décrite avec le virus HSV. La protéine virale ICP-47 agit
au niveau des molécules TAP (Transporter Associated with antigen
Processing"). Les protéines TAP sont ancrées dans
la membrane du réticulum endoplasmique. Elle sont responsables
de la translocation des peptides antigéniques du cytosol vers
la lumière du réticulum où les antigènes
s'associent avec les molécules de classe I du CMH. En se fixant
aux protéines TAP, la protéine ICP-47 du virus HSV inhibe
la translocation des peptides vers la lumière du réticulum
et donc la prise en charge des antigènes par les molécules
de classe I du CMH (Früh, Ahn et al. 1995; Hill, Jugovic et al.
1995).
De nombreuses autres molécules sont nécessaires à
l'interaction cellule T / cellule infectée. C'est le cas des
molécules d'adhésion. Des virus agissent également
sur l'expression de ces molécules à la surface cellulaire
et altèrent ainsi l'interaction des cellules infectées
avec les cellules T. Le virus EBV induit une régulation négative
des molécules LFA-3 et ICAM-1 dans les lymphomes de Burkitt,
ce qui rend ces cellules résistantes à la lyse par les
cellules T cytotoxiques (Gregory, Murray et al. 1988).
2-6 Induction d'une immunosuppression
L'un des moyens particulièrement efficace pour échapper
au système immunitaire est peut être d'agir directement
sur les effecteurs contrôlant l'infection. Plusieurs mécanismes
ont été décrits; en voici quelques exemples:
L'une des stratégies développées par les virus
est l'induction d'un état de tolérance. Dans ce cas, l'immunosuppression
est spécifique du virus et le système immunitaire n'est
globalement pas perturbé. Un exemple particulièrement
étudié est le cas de l'infection par le Virus de la ChorioMéningite
Lymphocytaire (LCMV). Des souris infectées par voie intrapéritonéale
à l'âge adulte éliminent le virus par une réponse
spécifique médiée par les cellules T CD8+. En revanche,
lorsque les souris sont infectées à la naissance ou in
utero, le virus persiste durant toute la vie de l'animal. La persistance
est liée à l'absence de réponse cellulaire T CD8+
dirigée contre le virus. Ainsi, lors de l'exposition précoce
au virus LCMV, il y adélétion thymique des cellules T
dirigées contre le virus. Cette sélection négative
des clones CLTs CD8+ spécifiques du virus LCMV conduit au développement
d'un état de tolérance vis à vis du virus et permet
l'établissement de la persistance (Ahmed et Stevens 1990; Oldstone
1989).
Contrairement à l'immunosuppression spécifique évoquée
ci-dessus, des virus peuvent induire un boulversement important du système
immunitaire conduisant à une immunosuppression généralisée.
C'est le cas de certains virus qui se répliquent dans les cellules
du système immunitaire, en particulier dans les cellules lymphoïdes.
Ainsi, l'infection des cellules T CD4+ et des macrophages par le virus
HIV aboutit à une immunodéficience généralisée.
Un autre exemple est celui du virus de la rougeole qui peut induire
une immunosuppression généralisée suite à
une infection des lymphocytes.
Certains virus perturbent la réponse immunitaire en interférant
avec le mode d'action des cytokines. Ce mécanisme a été
décrit en particulier avec les poxvirus dont le représentant
est le virus de la vaccine (pour revue, Alcami et Smith 1994). Le gène
B15R de ce virus code pour une glycoprotéine soluble qui présente
une forte analogie avec le récepteur de l'interleukine-1b
(IL-1b). La glycoprotéine virale est
capable de fixer l'IL-1b et d'inhiber ainsi
la fixation de la cytokine sur son récepteur cellulaire (Alcami
et Smith 1992; Spriggs, Hruby et al. 1992). Les poxvirus peuvent égale
met agir au niveau de la production de l'IL-1b.
Celle-ci est produite sous forme d'un précurseur qui doit être
clivé par une protéase, l'ICE (IL-1b
Converting Enzyme). Le virus cowpox code pour une protéine, crmA
(Cytokine Response Modifier A) qui inhibe l'action de l'ICE et donc
la production d'IL-1b mature (Ray, Black
et al. 1992). L'IL-1b joue entre autres un
rôle important dans l'initiation des réponses inflammatoires
et immunitaires lors d'une infection. L'inhibition de l'activité
de cette cytokine peut ainsi faciliter la propagation du virus au sein
de l'hôte.
La synthèse de molécules virales homologues à des
cytokines pourrait également être à l'origine d'une
perturbation de la réponse immunitaire. Le virus Epstein-Barr
code pour une protéine (BCRF1) qui présente une forte
homologie de séquence avec l'interleukine-10 (IL-10) (Moore,
Vieira et al. 1990). IL-10 est une cytokine produite par des cellules
T de la voie TH2 et inhibe la production de cytokines (en particulier
l'IFNg) par les cellules de la voie TH1.
La protéine BCRF1 possède in vitro des propriétés
analogues à celles de l’ IL-10 (Hsu, De Waal Malefyt et
al. 1990), à savoir l'inhibition de la production d'IFNg
par des cellules T. Ces résultats suggèrent que lors d'une
infection par le virus Epstein-Barr, la protéine virale BCRF1
pourrait perturber les réponses immunitaires de la voie TH1 et
faciliter ainsi l'échappement du virus au système immunitaire.
En conclusion, les mécanismes par lesquels un virus peut échapper
à la réponse immunitaire sont variés. La liste
citée ci-dessus est non exhaustive et illustre seulement la diversité
des stratégies que peuvent utiliser les virus. il est très
probable que dans la plupart des cas, l'infection persistante est la
résultante de plusieurs de ces mécanismes. Un aspect important
de la persistance virale est le site de persistance. Celui ci joue un
rôle primordial dans la capacité du virus à persister.
En effet, le virus peut se dissimuler dans des sites peu accessibles
au système immunitaire.
II- LES SITES DE PERSISTANCES
VIRALES
A - Généralités
De nombreux organes peuvent être des sites d'infection
virale. Ceux ci dépendent de la famille de virus concernée,
de l'hôte mais aussi du stade de l'infection virale. Ainsi, un même
virus peut infecter un tissu donné lors de l'infection précoce
et persister ensuite dans un autre organe. C'est le cas par exemple du
virus de la rougeole qui, lors de l'infection précoce, se réplique
majoritairement dans les cellules épithéliales de la peau,
de la trachée respiratoire, de l'oropharynx et des conjonctives.
Dans de rares cas, l'infection est suivie par une maladie tardive due
à une infection persistante du SNC.
Dans le cas des infections persistantes à cytomégalovirus
(CMV), le virus peut être retrouvé dans différents
tissus comme les tissus lymphoïdes, les reins, les glandes salivaires
et être à l'origine de pathologies variées comme des
pneumonies, des encéphalites, des rétinites.
Malgré la diversité des tissus concernés par les
infections persistantes, les tissus lymphoïdes et le système
nerveux sont les deux sites les plus courants. L'infection des cellules
du système immunitaire permet une dissémination de l'agent
infectieux dans l'organisme mais peut en plus conduire à une immunossupression
de l'hôte, favorisant ainsi le maintien de la persistance virale.
Le système nerveux, et en particulier le SNC est un site privilégié
de persistance virale car il est relativement isolé du système
immunitaire.
B - Le système nerveux
central
1 - Données anatomiques sur le SNC
Le SNC est propice aux infections virales persistantes. Cette facilité
à maintenir une infection persistante est due en grande partie
au fait que le SNC est un tissu isolé de la circulation sanguine
par la barrière hémato-encéphalique. Ehrlich fut
le premier à identifier la présence de cette barrière.
Il observa qu'après injection intraveineuse de substances colorées
se fixant à l'albumine, on retrouvait ces colorants dans tous les
organes de l'organisme, à l'exception du cerveau et de la moelle
épinière. La barrière hémato-encéphalique
comprend des jonctions serrées entre les cellules endothéliales
des capillaires sanguins (Goldstein et Betz 1986). Ces jonctions serrées
empêchent l'entrée des constituants sanguins solubles ou
cellulaires à l'intérieur du SNC. Les prolongements cytoplasmiques
de cellules gliales du SNC, les astrocytes, sont associés aux cellules
endothéliales et participent également à la formation
de la barrière hémato-encéphalique.
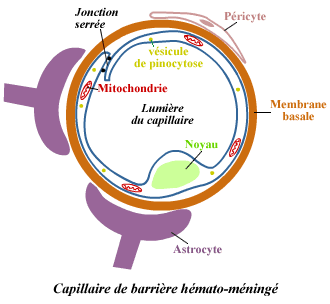
La barrière hémato-encéphalique
est formée par les cellules endothéliales des capillaires
sanguins et est caractérisée par l'existence de
jonction serrées. Les prolongements astrocytaires associés
aux cellules endothéliales participent à la formation
de la barrière hémato-encéphalique |
Celle ci permet le maintien de l'intégrité
du SNC en contrôlant l'entrée de diverses substances par
un transport actif spécifique à travers la barrière.
Le SNC est composé d'un nombre restreint de types cellulaires,
les neurones et les cellules gliales. Les corps cellulaires neuronaux
sont regroupés dans une zone macroscopiquement distincte, la substance
grise. Par opposition, la substance blanche comprend les axones. Les neurones
sont les cellules spécialisées dans la conduction et la
transmission de signaux électrochimiques. Il existe différents
types de neurones. Ceux ci ont des rôles bien spécifiques
et il est probable que la sensibilité à une infection virale
peut varier d'un type neuronal à l'autre.
Les cellules gliales sont divisées en plusieurs catégories:
les oligodendrocytes, les astrocytes et les cellules microgliales.

Représentation schématique
des différents types cellulaires du SNC
La figure montre la complexité
des intéractions entre les différents types cellulaire:
les neurones, les oligodendrycites dont la gaine de myéline
entoure les axones, les astrocytes qui établissent des
liens avec différentes cellules et en particulier avec
les cellules endothéliales des capillaires sanguins pour
former la barrière hémato-encéphalique (d'après
Kinelberg et Noremberg, 1989) |
Les oligodendrocytes possèdent un petit corps
cellulaire et de longs prolongements cytoplasmiques. Ces cellules sont
responsables de la formation de la gaine de myéline qui entoure
les axones et qui joue le rôle d'isolant électrique. Les
protéines de myéline sont synthétisées dans
le corps cellulaire puis sont ancrées dans la membrane des prolongements
cytoplasmiques des oligodendrocytes. La gaine de myéline est une
structure lamellaire, composée par des enroulements successifs
de prolongements cytoplamiques condensés autour de l'axone. La
propagation de l'influx nerveux est permise par l'existence de lacunes
dans la gaine de myéline, appelées noeuds de Ranvier. La
densité des canaux à Na+ est très élevée
au niveau des noeuds tandis que les régions de menbrane situés
entre les noeuds en contiennent peu ou pas. Les ions ne peuvent pas traverser
la membrane axonale dans les régions myélinisées.
Le potentiel d'action est donc généré au niveau du
noeud de Ranvier et la dépolarisation se propage le long de l'axone
jusqu'au noeud suivant. Une telle propagation du potentiel d'action permet
une conduction rapide de l'influx nerveux. Notons enfin que dans le système
nerveux périphérique, la gaine de myéline est formée
non pas par les prolongements cytoplasmiques des oligodendrocytes mais
par les cellules de Schwann.
Les astrocytes sont les cellules gliales les plus nombreuses. Ils sont
présents dans tout le SNC, à la fois dans la substance grise
et la substance blanche. Leurs fonctions sont multiples. Comme on l'a
vu, ils jouent un rôle structural essentiel dans la formation de
la barrière hémato-encéphalique. Mais ils assurent
également de multiples fonctions fondamentales pour l'équilibre
métabolique et fonctionnel du neurone. En effet l'astrocyte fournit
aux neurones des facteurs de croissance (NGF) et des facteurs neurotrophiques.
Chez l'embryon, le précurseur des astrocytes intervient dans la
migration des neurones et le guidage des axones grâce à des
molécules de surface permettant l'adhérance des neurones
à la glie. A l'âge adulte, les astrocytes jouent un rôle
essentiel dans la régulation de la transmission nerveuse en agissant
à la fois sur l'équilibre ionique et sur le taux extraneuronal
des neuromédiateurs (Tardy 1991). Les astrocytes pourraient également
être impliqués dans la modulation de la réponse immunitaire.
En effet, bien que les données in vivo restent controversées,
l'expression des molécules de classe II du CMH à la surface
des astrocytes ainsi que leur capacité de présentation des
antigènes ont été clairement
démontrés in vitro (Fontana, Fierz et al. 1984). L’expression
peut être stimulée in vitro par des cytokines telles que
l'IFNg ou lors d'infections virales avec par
exemple la souche JHM du virus de l'hépatite murine (Massa, Brinkmann
et al. 1987; Massa, Dorries et al. 1986). D'autre part, le niveau d'expression
des molécules de classe I du CMH est relativement faible mais peut
également être stimulée par l'IFNg
ou lors d'infections virales comme cela a été démontré
in vitro et in vivo avec le virus de l'hépatite murine (MHV) (Gilmore,
Correale et al. 1994; Gombold et Weiss 1992). La vaste répartition
anatomique des astrocytes dans le SNC laisse présager de multiples
fonctions et est l'indice d'échanges importants. Ces cellules établissent
des liens avec les différentes cellules du SNC. Leurs prolongements
cytoplasmiques sont en contact avec des neurones, mais aussi avec les
cellules épendymaires et les olygodendrocytes.
Initialement décrite au début du siècle, la microglie
doit son appellation à un caractère morphologique qui, dans
le tissu adulte, la différencie des autres types cellulaires gliaux
que sont les astrocytes et les oligodendrocytes: un corps cellulaire de
dimension réduite et de longs prolongements tortueux et ramifiés.
L'origine embryologique des cellules microgliales fait encore l'objet
de controverses. La microglie proviendrait de l'envahissement du tissu
par des monocytes circulants. Dans le cerveau immature, ces cellules sont
désignées sous le terme de macrophages cérébraux
ou cellules microgliales amiboïdes. Au cours du développement,
les cellules amiboïdes se différencient en cellules microgliales
ramifiées par une involution du corps cellulaire et la perte des
fonctions de phagocytose ainsi que l'émission de prolongements.
Dans les conditions physiologiques, les macrophages paraissent exclus
du tissu nerveux proprement dit, à l'exception de quelques régions
cérébrales comme la neurohypophyse. Cependant, lors de lésions
du tissu nerveux et donc en particulier de la barrière hémato-encéphalique,
les macrophages sont fréquemment retrouvés dans le SNC.
Lors d'une altération du tissu nerveux, l'origine des macrophages
recrutés semble être diversifiée. Une infiltration
de monocytes circulants et leur transformation en macrophages est claire
dans de nombreux contextes impliquant une altération des parois
vasculaires. Mais les macrophages cérébraux peuvent également
provenir d'une transformation "inverse" de cellules microgliales
ramifiées impliquant au niveau morphologique une hypertrophie du
corps cellulaire associée à une rétraction des prolongements.
Les macrophages cérébraux se distinguent des cellules microgliales
ramifiées du cerveau adulte par leur morphologie, leurs caractères
ultrastructuraux témoignant d'une activité de phagocytose,
et l'expression de divers marqueurs. Enfin, quelques données sur
les interactions entre le sang, le liquide céphalorachidien (LCR)
et le parenchyme cérébral devraient nous permettre de mieux
comprendre certains aspects du mode d'entrée des virus dans le
SNC. Les plexus choroïdes sont le site principal de production du
LCR. L'épithélium choroïdien est composé d'une
rangée de cellules épithéliales qui forment des invaginations
dans les cavités ventriculaires.
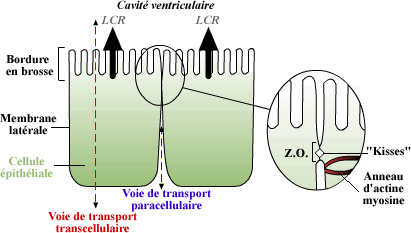
Représentation schématique
de l'épithélium choroïdien
La structure de la Zonula
Occludens (ZO), ou jonction serrée, est représentée
dans la partie agrandie de la figure. Les voies de transport (transcellulaire
ou paracellulaire) des molécules à travers les plexus
choroïde sont indiquées. Le Liquide Céphalo-Rachidien
(LCR) est synthétisé dans le plexus choroïde
et est dirigé dans les ventricules à travers les
microvillosité de la bordure en brosse |
Des protéines, des virus, des anticorps ainsi
que certaines substances chimiques peuvent entrer assez facilement dans
les espaces interstitiels des plexus choroïdes. La sélectivité
de leur passage intervient par la suite au niveau de la zone épithéliale
laminaire qui constitue la barrière entre le sang et le LCR (Maxwell
et Pease 1956; Van Deurs et Koehler 1979). En effet, des jonctions serrées
joignent les cellules épithéliales choroïdales adjacentes,
créant ainsi une barrière entre le sang et les ventricules.
Le transport des molécules à travers l'épithélium
choroïdal dépend de la charge et de la taille des molécules.
Le transport via des vésicules joue probablement un rôle
prépondérant dans le transfert des macromolécules
par les plexus choroïdes. Une fois qu'une substance a pénétré
dans le LCR, le transfert à l'intérieur du parenchyme cérébral
se fait relativement facilement (Brightman 1967). Notons que l'utilisation
de certains médicaments destinés à traiter des infections
du SNC utilisent cette voie d'entrée.
2 - Infections persistantes du SNC
L'intégrité du SNC est protégée par la barrière
hémato- encéphalique. Cependant, un grand nombre d'infections
virales peuvent se propager jusqu'au SNC. Quels sont les mécanismes
qui permettent à un virus d'entrer dans le SNC en dépit
de l'existence de la barrière hémato-encéphalique?
Généralement, le virus se réplique dans un site primaire
d'infection puis atteint ensuite le SNC. Il y adeux voies possibles d'entrée
dans le SNC: par le sang en traversant la barrière hémato-encéphalique
ou par transport axonal rétrograde (Griffin 1990). L'entrée
par la voie sanguine est la plus répandue.
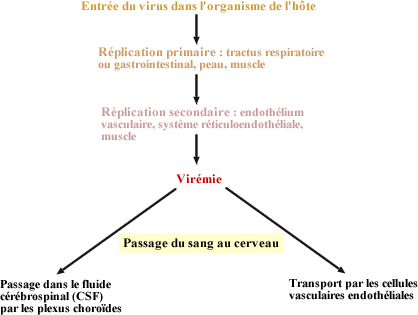
Exemple d'entrée dans le SNC par
la voie hématogène d'une infection par un entérovirus
(d'après Schlitt et al., 1991) |
En effet, une infection virale est habituellement suivie
d'une virémie qui permet la propagation du virus dans tout l'organisme.
Les virus peuvent alors entrer dans le SNC en infectant directement les
cellules endothéliales des capillaires sanguins du cerveau. Après
inoculation intrapéritonéale, le virus Semliki passe du
sang dans le SNC par les cellules endothéliales des capillaires
cérébraux (Pathak et Webb 1974; Soilu-Hanninen, Eralinna
et al. 1994). D'autres virus infectent les cellules épithéliales
des plexus choroïdes et passent ensuite dans le liquide céphalorachidien.
C'est probablement le cas du virus Visna pour lequel on retrouve de l'ADN
proviral dans les cellules des plexus choroïdes (Brahic, Stowring
et al. 1981). Il a été suggéré que l'entrée
dans le SNC pourrait se faire via l'infection de lymphocytes ou de macrophages
dans les cas du virus de la maladie de Carré du chien (Canine Distemper
virus ou CDV) (Summers, Griesen et al. 1978), des virus HTLV-1 et HIV
mais ces données restent controversées.
Le second moyen d'entrée dans le SNC est le transport par voie
axonale rétrograde depuis la périphérie. En effet,
la périphérie est innervée par des axones. Ainsi,
des neurones peuvent avoir des prolongements cytoplasmiques qui atteignent
la peau et les muscles et.. des substances peuvent être transportées
du SNC vers la périphérie mais aussi de la périphérie
vers le SNC. Le transport axonal est la voie d'entrée dans le SNC
du virus de la rage (Murphy 1977), du virus HSV (Baringer 1975), ainsi
que de certains réovirus. Lors de l'infection naturelle par le
virus de la rage (morsure), les premiers sites de réplication du
virus sont les myocytes. La réplication active du virus lui permet
d'envahir les jonctions neuromusculaires et d'être finalement transporté
par voie axonale (figure 5) (Schlitt, Chronister et al. 1991).

Exemple d'entrée dans le SNC par
la voie axonale lors de l'infection par le virus de la rage |
Notons cependant que, chez la souris, il a été
montré que la souche CVS du virus de la rage pénètre
directement dans les terminaisons nerveuses sans multiplication dans le
muscle. Ce virus peut emprunter à la fois les voies sensitives
et motrices (Coulon, Derbin et al. 1989). Dans le cas du poliovirus, la
propagation du virus peut conduire à une infection des neurones
moteurs de la corne antérieure de la mœlle épinière
ainsi que du cerveau et être à l'origine de la poliomyélite.
Le virus peut atteindre la moelle épinière par la voie sanguine
après réplication dans le tractus gastrointestinal mais
peut également emprunter la voie nerveuse. L'infection du système
nerveux par le poliovirus conduit à une destruction des cellules
de la corne antérieure de la moelle épinière, conduisant
à une paralysie précoce suivie d'une atrophie musculaire.
Rappelons tout de même que à la suite de l'infection par
le poliovirus, peu d'individus développent la maladie nerveuse.
Le SNC a longtemps été considéré comme un
tissu inaccessible aux effecteurs de la réponse immunitaire à
cause de la présence de la barrière hémato-encéphalique.
Cependant, des études ont montré que des lymphocytes T activés
pouvaient entrer dans le SNC à faible niveau dans les conditions
normales et à des taux élevés lors de maladies neurologiques
comme la sclérose en plaques ou l'encéphalomyélite
allergique expérimentale (EAE) (Hickey, Hsu et al. 1991; Wekerle,
Linington et al. 1986). L'EAE est induite chez les animaux après
immunisation avec la protéine basique de la myéline (MBP)
ou par transfert de cellules T CD4+ spécifiques de la myéline.
L'entrée des lymphocytes dans le SNC est contrôlée
par la barrière hémato-encéphalique et en particulier
par les cellules endothéliales qui la constituent. Quel que soit
le tissu, le passage des leucocytes à travers l'endothélium
nécessite une intéraction entre des molécules d'adhésion
exprimées à la surface des cellules endothéliales
et les récepteurs correspondant présents à la surface
des leucocytes. Dans les conditions physiologiques normales, l'adhésion
des lymphocytes sur les cellules endothéliales du SNC est très
limitée, ce qui peut expliquer la restriction du passage des lymphocytes
non activés à travers la barrière. Cependant, lors
de processus inflammatoires, il y a induction de l'expression de molécules
d'adhésion à la surface des cellules endothéliales
du SNC, telles que ICAM-1, VCAM-1, LFA-3. D'autre part, la perméabilité
de l'endothélium est modulée par des cytokines telles que
l'IL-1 et le TNF-a. Ainsi, suite à une
réaction inflammatoire, il y aurait augmentation de la perméabilité
de la barrière hémato- encéphalique ainsi qu'une
induction de l'expression des molécules d'adhésion à
la surface des cellules endothéliales. Ces changements pourraient
être responsables de l'infiltration des cellules immunitaires dans
le SNC (pour revue, Couraud 1994).
Un aspect important de la persistance virale dans le SNC est la nature
des cellules infectées. Ainsi, une infection des neurones est un
moyen supplémentaire de rester à l'abri de la réponse
immunitaire car ces cellules n'expriment normalement pas de molécules
de classe I du CMH. Dans ces conditions, des neurones infectés
ne sont pas reconnus par les cellules T CD8+ et échappent donc
à la lyse par les CTLs. Lors de l'infection persistante par le
virus LCMV, les neurones sont quasiment les seules cellules infectées
du SNC. Durant cette période, le transfert par voie intracranienne
de CTLs spécifiques du virus LCMV ne permet pas d'éliminer
le virus du SNC (Joly, Mucke et al. 1991a). En revanche, dans des souris
transgéniques exprimant une molécule de classe I (Db) sous
contrôle du promoteur neuronal NSE (Neuron-Specific Enolase), le
transfert de clones CTLs permet une élimination presque totale
du virus (RaIl, Mucke et al. 1995). Ces résultats montrent que
la persistance du virus LCMV dans le SNC est fortement liée à
l'absence d'expression des molécules de classe I du CMH à
la surface des neurones. Cependant, lors de la perte de fonctionnalité
du neurone, il peut y avoir induction de l'expression de molécules
de classe I du CMH à la surface cellulaire (Neumann, Cavalié
et al. 1995). On ne peut donc pas écarter l'hypothèse que
les perturbations entrainées lors d'une infection virale pourraient
conduire à une expression des molécules de classe I à
la surface des neurones infectés.
Les pathologies dûes à des infections virales du SNC sont
variées. Elles dépendent en grande partie du type cellulaire
infecté. Ainsi, les infections des neurones peuvent conduire à
des encéphalites ou des paralysies comme dans le cas des infections
par le poliovirus. L'infection du SNC peut conduire à une démyélinisation
(revue Fazakerley). Chez l'homme, plusieurs infections virales du SNC
sont associées à des lésions de démyélinisation.
C'est le cas en particulier avec les virus HTLV-1, HIV, le virus de la
rougeole ou encore le virus JC. Chez l'animal, c'est le cas du virus Visna,
du virus de Theiler, du virus MHV, du virus Semliki (Semliki Forest virus),
du virus de la maladie de Carré du chien. La plupart de ces virus
infectent les oligodendrocytes qui sont les cellules responsables de la
production de myéline. Cependant, il existe des cas de démyélinisation
sans infection des oligodendrocytes. Le virus de la maladie de carré
du chien induit une démyélinisation dans le SNC alors qu'il
n'infecte que très rarement les oligodendrocytes. Il a été
proposé que la démyélinisation induite par ce virus
pourrait être une conséquence de l'infection et de l'altération
des fonctions des astrocytes (Summers et Appel 1987; Zurbriggen, Vandevelde
et al. 1986). Ainsi, la démyélinisation n'est pas forcément
dûe à un effet directe du virus sur les oligodendrocytes.
Elle peut également être médiée par la réponse
immunitaire. L'implication du système immunitaire dans la démyélinisation
a entre autre été montré lors de l'infection par
le virus Semliki. En effet, dans des souris athymiques nu/nu, le virus
établit une infection persistante dans le SNC sans provoquer de
lésions de démyélinisation. Les lésions apparaissent
par transfert de cellules T dans ces souris (Fazakerley, Amor et al. 1983;
Fazakerley et Webb 1987). Des expériences de déplétion
en lymphocytes T CD4+ ou CD8+ ont montré que la démyélinisation
est médiée par les cellules T CD8+ (Subak-Sharpe, Dyson
et al. 1993).
En conclusion, bien que n'étant pas complètement à
l'abri des réponses immunitaires, le SNC est un tissu relativement
propice aux infections virales persistantes. Le tropisme représente
un aspect important de la persistance puisque l'accès du virus
à un site peu accessible au système immunitaire conditionne
l'établissement et le maintien de la persistance. La capacité
d'un virus à infecter tel ou tel type cellulaire et à persister
dans ces cellules est avant tout contrôlée par un certain
nombre de déterminants génétiques du virus.
III- LES DETERMINANTS GENETIQUES
VIRAUX DE LA PERSISTANCE
A - Généralités
De nombreuses études s'intéressent à
l'identification de déterminants génétiques de la
persistance. Cette approche fait souvent appel à des souches virales
très proches au niveau génomique et ayant des phénotypes
différents. Dans plusieurs systèmes, il apparaît clairement
qu'une modification d'un seul nucléotide peut changer la pathologie
induite par le virus. Par exemple, le changement C->U en position 472
dans la partie 5' non codante du génome du polio virus de type
3 abolit la capacité de réplication du virus dans le SNC
de la souris et le rend non virulent (La Monica, Almond et al. 1987).
De même, une substitution Arg->Glu ou Gly en position 333 dans
la glycoprotéine d'enveloppe de la souche CVS du virus de la rage
rend le virus non virulent chez la souris (Seif, Coulon et al. 1985).
Les modifications génétiques n'entraînent pas forcément
des changements d'acides aminés puisqu'elles existent également
dans des régions non codantes. Ceci illustre bien la complexité
des interactions hôte-virus qui contrôlent l'infection et
la pathologie. Des mutations au niveau nucléotidique peuvent entraîner
des modifications dans la capacité de réplication du virus
ou dans des interactions avec des facteurs cellulaires. Des changements
d'acides aminés peuvent modifier des épitopes et donc altérer
la reconnaissance par la réponse immunitaire. Un changement d'acide
aminé peut également modifier l'interaction du virus avec
son récepteur cellulaire et donc moduler le tropisme viral.
Dans ce chapitre, nous nous limiterons à la description d'un exemple
pour lequel il a été établi de façon claire
un lien direct entre des mutations ponctuelles, le tropisme du virus et
sa capacité à persister. Il s'agit du Virus de la ChorioMéningite
Lymphocytaire (LCMV).
B - Le Virus de la ChorioMéningite Lymphocytaire
(LCMV)
Le virus LCMV est un arénavirus. La persistance
de ce virus dans la souris ainsi que le rôle des CTLs CD8+ dans
l'infection ont été largement étudiés. Lorsque
des souris adultes sont infectées par voie intrapéritonéale
par la souche sauvage Armstrong (ARM), il y ainduction d'une forte réponse
cellulaire T CD8+ et le virus est éliminé de l'organisme
en deux semaines. Le phénotype de ce virus est noté schématiquement:
CTL + , P- (présence de CTLs spécifiques du virus, absence
de persistance dans les souris adultes). Par opposition, lorsque des souris
sont infectées in utero ou à la naissance, les clones CTLs
CD8+ spécifiques du virus sont délétés lors
de la maturation thymique et il y ainduction d'un état de tolérance
vis à vis du virus. Celui-ci persiste durant toute la vie de l'animal.
L'immunosuppression est spécifique des clones réagissant
contre le virus et on n'observe pas d'immunossupression généralisée.
De nombreux tissus sont infectés, en particulier le SNC, la rate
le foie et les reins. Dans des souris infectées de façon
persistante, des virus ont été isolés à partir
du SNC et des organes lymphoïdes. Dans tous les cas, les virus isolés
à partir du SNC ont le même phénotype que la souche
sauvage ARM, (CTL +, P-), lorsqu'ils sont inoculés à des
souris adultes. En revanche, des variants viraux ont été
isolés à partir des organes lymphoïdes. C'est le cas
de la souche ARM clone 13 ( ARM c.13). Ce virus a été isolé
à partir de la rate d'une souris infectée de façon
persistante. Lorsque des souris adultes sont infectées avec le
virus ARM c.13, il y a dissémination de l'infection dans de nombreux
organes et le virus persiste pendant plusieurs mois. Cette infection persistante
est associée à une immunosuppression généralisée
et à une sensibilité accrue aux infections opportunistes.
Le phénotype de ce virus est noté CTL -, p+ (pas de réponse
cytotoxique cellulaire et persistance du virus chez les souris adultes)
(Ahmed, Jamieson et al. 1987; Ahmed, Salmi et al. 1984).
La capacité du variant ARM c.13 à induire une immunossupression
et à persister est liée à l'apparition de mutations
responsables d'un tropisme préférentiel pour les macrophages.
Des études in vitro montrent que le variant ARM c.13 pénètre
beaucoup plus efficacement dans les macrophages que la souche sauvage
ARM. De plus, la souche ARM se réplique très mal dans les
macrophages, contrairement au clone 13. Cette différence est spécifique
des macrophages puisqu'elle ne s'observe pas dans d'autres types cellulaires.
La différence de tropisme est confirmée par les études
i n vivo dans des souris infectées à l'âge adulte
par l'une ou l'autre des deux souches. Avec la souche ARM sauvage, il
y a très peu de macrophages infectés, une baisse rapide
de la virémie et le virus reste dans les sites primaires d'infection
(le foie, la rate, les poumons) avant d'être éliminé.
En revanche, il y aune infection massive des macrophages avec le variant
ARM c.13, une augmentation de la virémie et une dissémination
du virus dans de nombreux organes, y compris le SNC (Matloubian, Kolhekar
et al. 1993). Ainsi, l'infection des macrophages par le clone 13 joue
un rôle primordial pour l'établissement de la persistance:
les macrophages permettent une dissémination du virus dans tout
l'organisme et donc l'accès à des sites privilégiés
de persistance. D'autre part, l'infection des macrophages peut être
à l'origine de l'immunosuppression. En effet, ces cellules jouent
un rôle clé dans la présentation des peptides viraux
aux cellules T, par les voies des classes I ou II du CMH. Elles modulent
également la réponse immunitaire par production de cytokines.
La perturbation de la fonction des macrophages peut donc être à
l'origine de l'immunossupression observée lors de l'infection persistante
par le variant ARM c.13.
Le tropisme de ce virus pour les macrophages lui confère la capacité
de persister. Celle-ci est liée à l'apparition de deux mutations
dans le génome viral: une mutation Lys->Glu en position 1079
dans la polymérase et une mutation Phe->Leu en position 260
dans la glycoprotéine d'enveloppe. Il est probable que la mutation
dans la glycoprotéine d'enveloppe module l'efficacité d'interaction
du virus avec un récepteur cellulaire macrophagique. En effet,
l'efficacité de fixation et de pénétration du virus
ARM c.13 dans les macrophages est supérieure à celle du
virus sauvage ARM. Mais le tropisme pour les macrophages ne fait pas seulement
appel à une interaction virus- récepteur puisque la mutation
dans la polymérase est également nécessaire à
l'infection de ces cellules. Le mécanisme par lequel cette mutation
joue un rôle dans l'infection des macrophages n'est pas connu. Cette
mutation affecte le taux d'ARN viral seulement dans les macrophages, ce
qui suggère que l'acide aminé 1079 de la polymérase
est important pour l'interaction avec des facteurs cellulaires spécifiques
du macrophage.
En conclusion, le virus LCMV représente un exemple pour lequel
on a pu identifier des mutations et corréler ces mutations à
une modification du tropisme viral et à la capacité du virus
à persister. Cet exemple illustre également l'importance
du tropisme pour la persistance virale.
BIBLIOGRAPHIE:
-Marion et Robinson 1983
-Roizman et Sears 1987
-Stevens 1989
-Korba, Cote et al. 1988
-Rickinson 1988
-Yao, Rickinson et al. 1985
-He, Treacy et al. 1989
-Stevens, Wagner et al. 1987
-Sedarati, Izumi et al. 1989
-Garcia- Blanco et Cullen 1991
-Cattaneo et Billeter 1992
-Hummel, Vanchiere et al. 1994
-R. Ahmed et J.G. Stevens, 1990
-Holland, De La Torre et al. 1991
-Holland, Spindler et al. 1982
-Clements, Gdovin et al. 1988
-Narayan, Zink et al. 1988
-Mateu, Martinez et al. 1989
-Parry, Fox et al. 1990
-Oldstone 1984
-Flamand, Raux et al. 1993
-Raux, Coulon et al. 1995
-Barrett et Dimmock 1986
-Huang et Baltimore 1970
-Stevens 1989
-Joly, Mucke et al. 1991b
-Andersson, Paabo et al. 1985
-Burgert, Maryanski et al. 1987
-Bernards, Schrier et al. 1983
-Paabo, Nilsson et al. 1986
-Früh, Ahn et al. 1995
-Hill, Jugovic et al. 1995
-Gregory, Murray et al. 1988
-Oldstone 1989
-Alcami et Smith 1994
-Alcami et Smith 1992
-Spriggs, Hruby et al. 1992
-Ray, Black et al. 1992
-Moore, Vieira et al. 1990
-Hsu, De Waal Malefyt et al. 1990
-Goldstein et Betz 1986
-Kinelberg et Noremberg, 1989
-Tardy 1991
-Fontana, Fierz et al. 1984
-Massa, Brinkmann et al. 1987
-Massa, Dorries et al. 1986
-Gilmore, Correale et al. 1994
-Gombold et Weiss 1992
-Maxwell et Pease 1956
-Van Deurs et Koehler 1979
-Brightman 1967
-Griffin 1990
-Pathak et Webb 1974
-Soilu-Hanninen, Eralinna et al. 1994
-Brahic, Stowring et al. 1981
-Summers, Griesen et al. 1978
-Murphy 1977
-Baringer 1975
-Schlitt, Chronister et al. 1991
-Coulon, Derbin et al. 1989
-Hickey, Hsu et al. 1991
-Wekerle, Linington et al. 1986
-Couraud 1994
-RaIl, Mucke et al. 1995
-Neumann, Cavalié et al. 1995
-Summers et Appel 1987
-Zurbriggen, Vandevelde et al. 1986
-Fazakerley, Amor et al. 1983
-Fazakerley et Webb 1987
-Subak-Sharpe, Dyson et al. 1993
-La Monica, Almond et al. 1987
-Seif, Coulon et al. 1985
-Ahmed, Jamieson et al. 1987
-Ahmed, Salmi et al. 1984
-Matloubian, Kolhekar et al. 1993 |
|