LA PRESENTATION DE L’ ANTIGENE AUX
CELLULES T
d'après le cours de Claude LECLERC
I- PRESENTATION DE L'ANTIGENE AUX CELLULES T CD4+
PAR LES MOLECULES DU CMH DE CLASSE II
A - Introduction
L'activation des cellules T helper CD4+ (T auxiliaires)
est un évènement crucial dans l'induction d'une réponse
immunitaire. Contrairement aux cellules B qui lient directement l'antigène,
les cellules T ne reconnaissent l'antigène qu'en association avec
des produits du CMH (Complexe Majeur d'Histocompatibilité) exprimés
à la surface de cellules: les cellules présentant l'antigène
(CPA). L'antigène n'est pas reconnu sous sa forme native, mais
uniquement après avoir subi des transformations physicochimiques
(le "processing" des anglo-saxons). C'est cette forme modifiée
de l'antigène qui, complexée avec des molécules du
CMH de la CPag (cellules présentant l'antigène),
est reconnue par le récepteur des cellules T.
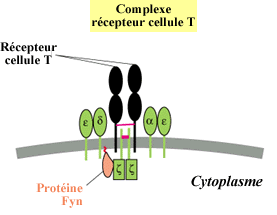
B - Historique
1 - L'activation des cellules T auxiliaires nécessite
la présence de cellules présentant l'antigène
L'expérience de base ayant permis la démonstration que l'activation
des cellules T nécessitait la présence de macrophages a
été réalisée en utilisant des cellules de
ganglions d'un cobaye immunisé par un antigène donné
et purifiées afin de ne contenir pratiquement que des lymphocytes
T. Ceux-ci, mis en présence de l'antigène ayant servi à
l'immunisation, ne prolifèrent pas. Par contre, ces mêmes
cellules T mises en présence de l'antigène et de cellules
macrophagiques (préparées à partir de cellules d'exsudat
péritonéal: PEC, pour Peritoneal Exsudat Cells) prolifèrent
de façon importante.

L'antigène seul ne suffit pas à activer la prolifération
des lymphocytes T
2 - L'interaction macrophages-cellules T helper
(CD4+) est restreinte par les antigènes du CMH de classe II
Utilisant le même modèle expérimental, Rosenthal et
Shevach en 1974 ont démontré que l'interaction macrophages-cellules
T est soumise à contrainte génétique au niveau du
complexe majeur d'histocompatibilité (CMH).
Utilisant deux souches de cobayes différant au niveau du CMH, les
souches 2 et 13, ils démontrent que les lymphocytes T d'une souche
ne prolifèrent que si l'antigène est présenté
par les macrophages de la même souche (ou de l'hybride F1). Si les
macrophages proviennent d'une autre souche, il n'y a pas ou peu de prolifération.
Ces expériences démontrent la nécessité de
l'identité du CMH pour une collaboration effective entre macrophages
et lymphocytes T.
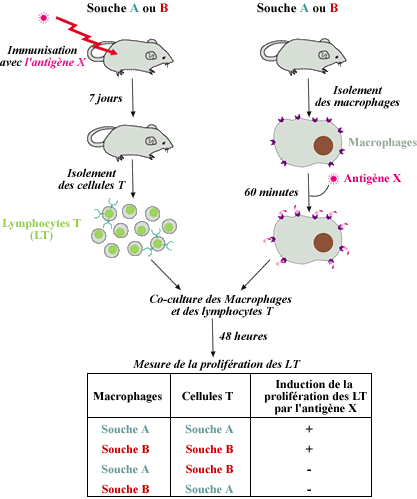
Restriction du CMH à la prolifération des lymphocytes
T
Ces résultats furent étendus à
la souris où une génétique plus fine a permis de
démontrer que la région du CMH impliquée était
la sous-région I-A codant pour les produits de classe II.
La plupart des études précédentes avaient utilisé
des "antigen-pulsed macrophages", c'est-à-dire que macrophages
et antigène étaient incubés ensemble, l'antigène
libre était éliminé par lavage, puis les macrophages
lavés étaient utilisés pour "présenter"
l'antigène. Quelle est donc la structure associée au macrophage
et stimulant les lymphocytes T ? Des études réalisées
avec de l'antigène marqué (par exemple, hémocyanine
marqué avec de l' 131Iode) ont montré que l'antigène
se fixe à la surface du macrophage, est internalisé puis
rapidement dégradé: une partie (80 %) de l'antigène
se retrouve dans le milieu de culture sous forme d' 131Iode
lié à des peptides. Cependant, 20 % restent associés
à la cellule. Le traitement à la trypsine de ces macrophages
"pulsés" n'affecte cependant pas leur capacité
à stimuler les lymphocytes T. De plus, l'antigène présenté
à la surface des macrophages n'est pas reconnaissable par des anticorps
ou accessible à ces anticorps dirigés contre la molécule
native: en effet, de tels anticorps n'inhibent pas la prolifération
T.
3 - Mise en évidence du phénomène
de "Processing"
La notion d'apprêtement de l'antigène (processing) a été
basée sur des observations d'abord établies par Ziegler
et Unanue, puis confirmées par de nombreux groupes.
Utilisant comme antigène les bactéries Listeria monocytogènes,
ils établirent les données fondamentales suivantes:
-Le macrophage phagocyte Listeria en quelques minutes. De 30 à
60 minutes lui sont par contre nécessaires pour présenter
l'antigène à des cellules T spécifiques de Listeria,
-Si les macrophages sont fixés après avoir été
incubés avec l'antigène suffisamment longtemps (une heure
par exemple), ils conservent leur capacité à présenter
l'antigène,
-Si les macrophages sont fixés avant d'être incubés
avec l'antigène, ils perdent leur capacité à stimuler
des lymphocytes T spécifiques de cet antigène.
De plus, le traitement des CPA avec des agents Iysosomotriques (chlorure
d'ammonium ou chloroquine) abolit totalement la capacité des CPA
à présenter l'antigène. Donc, l'antigène doit
rencontrer, à un moment donné, un compartiment intracellulaire
acide. Il y a corrélation entre l'inhibition de la dégradation
protéolytique de Listeria et l'inhibition de la capacité
à présenter l'antigène.
Le processing de l'antigène implique donc une fragmentation Protéolytigue.
4 - Le "Processing" de l'antigène
aboutit à sa fragmentation en peptides
En 1983, Shimonkevitz et Grey réalisent une expérience cruciale:
ils fixent des CPA à la glutaraldéhyde. Ceux-ci ne peuvent
présenter l'antigène (ovalbumine de poule) aux cellules
T. Mais, ils vont fractionner chimiquement et enzymatiquement (bromure
de cyanogène, trypsine) ce même antigène, l'ovalbumine.
Les CPA fixés à la glutaraldéhyde et mis en présence
de ces fragments sont capables de stimuler les lymphocytes T spécifiques.
Le processing de la CPA aboutit donc à la préparation de
peptides qui peuvent directement s'associer à cette même
cellule.
Parallèlement à ces travaux, Allen et Unanue démontraient
que des macrophages incubés avec des Listeria marquées relarguent
un certain nombre de peptides dont certains s'associent aux membranes
de macrophages.
De nombreux autres études ont suivi démontrant par l'utilisation
de peptides synthétiques que les cellules T reconnaissent, en association
avec les antigènes du CMH, de courtes séquences peptidiques
(une dizaine d'acides aminés) produits par le processing de l'antigène.
Diverses approches ont été récemment mises au point
pour déterminer la nature des peptides produits par le processing
physiologique et pouvant ensuite s'associer aux antigènes du CMH.
Les molécules de classe II de cellules CPA préalablement
incubés avec un antigène donné (notamment le Iyzozyme)
sont extraites des cellules puis purifiées. Les peptides liés
à ces molécules sont ensuite élués à
pH acide. Il a été ainsi possible d'identifier ces peptides
et de démontrer qu'il existe une population hétérogène
de peptides d'une taille allant d'environ 15 à 25 acides aminés,
mais possédant un "core" commun.
Récemment, le groupe de Janeway a purifié les antigènes
de classe II obtenus à partir de lignées cellulaires en
l'absence d'incubation avec un antigène exogène. Il a isolé
les peptides associés à ces molécules et a démontré
qu'il s'agit de peptides plus longs que ceux élués à
partir des classes I purifiées. Ceci implique des modalités
différentes d'interaction entre peptides et antigènes du
CMH de classe I et II, ce qui a été confirmé par
la cristallographie des molécules de classe I et II. Ces peptides,
présents en l'absence d'exposition des cellules à des antigènes
extérieurs, dérivent de peptides de la cellule ou de composants
de milieux de culture.
5 - Le complexe CMH-peptide
Il est maintenant bien établi que le processing de l'antigène
aboutit à la formation d'un complexe entre les molécules
de classe II présentes sur la CPA et le peptide produit par le
processing de l'antigène par cette même CPA.
Nous avons vu que le processing aboutissait à la fragmentation
de l'antigène. Il convenait de définir quel était
le produit de cette dégradation qui était reconnue par les
lymphocytes T.
Ces expériences furent réalisées par le groupe d'Unanue
en utilisant le lysozyme de blanc d'oeuf de poule (HEL) qui comprend 129
acides aminés. Des hybridomes T ont été générés
contre HEL présentés par des macrophages dans le contexte
IAK. Unanue et coll. ont ainsi défini un produit de digestion de
HEL par la trypsine qui peut stimuler les hybridomes T en étant
présenté par des CPA fixés (et donc incapables de
processing). Ils ont ensuite pu identifier le peptide concerné,
en faire la séquence, puis synthétiser chimiquement ce même
peptide. Une telle démarche a été suivie par d'autres
groupes avec succès pour d'autres modèles expérimentaux.
Le produit du processing de l'antigène par la CPA est un peptide
d'une dizaine d'acides aminés (pour le lysozyme, on a défini
par exemple le peptide HEL (52-61 ).
Ce peptide forme un complexe avec une molécule de classe II. Cette
interaction fut pour la première fois démontrée par
le groupe d'Unanue en 1985. Le peptide HEL (46-61) est immunogène
chez les souris H- 2K, mais non chez les H-2b. Des
hybridomes T d'origine H- 2K prolifèrent en présence
de HEL (46-61), si celui-ci est présenté sur les CPA appropriés.
Ce même peptide, fluorescent, est capable de se lier aux molécules
I-AK purifiées. Cette fixation est saturable, inhibable
par le peptide non marqué, indiquant la spécificité
de l'interaction. La constante de dissociation (KD) est de 2 mM.
De plus, le peptide HEL (46-61) ne se fixe pas sur les molécules
I-Ad (haplotype non répondeur).
Ces données ont été généralisées
par Howard Grey, Soren Buus, et leur groupe. Ils ont démontré
la corrélation entre capacité de se fixer à des molécules
de classe II et capacité de stimuler des lymphocytes T. Des expériences
d'inhibition ont montré que, pour une molécule de classe
II donnée, tous les peptides testés se fixaient sur le même
site (agrétope interne). Le site de liaison implique les chaînes
a et b de la molécule du CMH. L'interaction CMH-peptide est très
lente, mais stable une fois réalisée (association rate:
1 m-1s-1 , dissociation constante: 1 à 1 0 mM).
II- DEGRADATION
DES PROTEINES EN FRAGMENTS PEPTIDIQUES
L'existence de
plusieurs classes de molécules du CMH permet l'adaptation du système
immunitaire aux différents antigènes qu'il est susceptible
de rencontrer. En effet, les molécules de classe I du CMH sont
responsables de la présentation d'antigènes présents
dans le cytosol de la CPA, appelés antigènes endogènes,
alors que les molécules de classe II sont spécialisées
dans la fixation de peptides provenant d'antigènes exogènes,
internalisés depuis l'environnement extracellulaire par endocytose.
Les protéines exogènes intègrent successivement les
différents compartiments de la voie endocytique où elles
sont dégradées par diverses enzymes protéolytiques.
En effet, les protéines nécessitent un apprêtement
intracellulaire générant des peptides capables de s'associer
aux molécules du CMH de façon efficace.
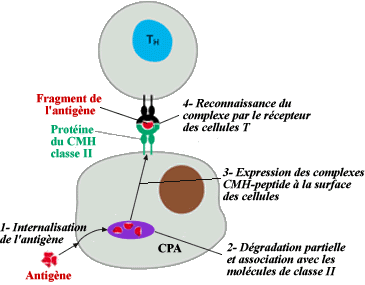
Présentation d'un peptide exogène par la protéine
CMH II
L'efficacité et la qualité de l'apprêtement
de l'antigène dépendent de la complexité de la protéine
à dégrader, de ses sites d'action pour les protéases
et de la nécessité de dénaturer la protéine
avant sa protéolyse. Par exemple, certains antigènes, comme
le lysozyme, l'insuline ou la toxine a de serpent, nécessitent
la réduction de ponts disulfures préalablement à
l'action des protéases. L'activité optimale des protéases
requiert un pH acide entre 3 et 6, par conséquent leur efficacité
sera modulée en fonction du compartiment endocytique où
elles agissent. Ainsi, des antigènes encapsulés dans des
liposomes se dissociant au pH des lysosomes sont apprêtés
plus efficacement que des antigènes transportés dans des
liposomes libérant l'antigène au niveau des endosomes plus
précoces. De nombreuses familles de protéases sont présentes
dans les compartiments endocytiques, dont les cathepsines. On distingue
les cathepsines B, H, L (cystéine protéases) et les cathepsines
D et E (aspartyl protéases), qui ont pu être colocalisées
avec les molécules de classe II dans ces vésicules. Chaque
protéase est caractérisée par des sites préférentiels
de clivage et l'action simultanée de plusieurs protéases
a été mise en évidence pour certains antigènes.
Au contraire, les molécules de classe I présentent des protéines
endogènes, produites dans le cytoplasme de la cellule au cours
du renouvellement des protéines cellulaires ou au cours d'infections
bactériennes ou virales ou encore lors du développement
de tumeurs. Ces protéines sont dégradées en fragments
peptidiques dans le cytosol. La protéolyse est assurée par
un complexe multiprotéique, appelé protéasome, dont
certaines sous-unités sont codées par des gènes inductibles
par l'IFNg, LMP2 et LMP7. Ce processus est
dépendant de l'ATP et se déroule généralement
après ubiquitination des protéines. L'activité enzymatique
du protéasome est modulée par l'expression différentielle
de certaines sous-unités par rapport à d'autres.
Cette corrélation entre l'origine des antigènes et la classe
de molécule du CMH à laquelle ils s'associent, comporte
des exceptions au cours desquelles des antigènes endogènes
sont présentés par des molécules de classe II, ou
des antigènes exogènes peuvent être associés
à des molécules de classe I. Par exemple, de fortes doses
d'ovalbumine sous forme soluble peuvent être présentées
en association aux molécules de classe I. Une présentation
efficace d'antigène exogène par des molécules de
classe I est observée, i n vitro et in vivo, lorsque la protéine
est couplée à des particules synthétiques de latex.
Les macrophages sont responsables de cette voie de présentation
grâce à la phagocytose des particules qui transitent par
les phagolysosomes et se retrouvent ensuite dans le cytosol des macrophages,
devenant ainsi accessibles à la voie endogène classique
de présentation par les molécules de classe I. Un autre
mécanisme a également été suggéré
au cours duquel les peptides sont générés dans les
compartiments intracellulaires des macrophages puis libérés
pour se fixer aux molécules de classe I présentes à
la surface d'autres cellules. Par ailleurs, il a été démontré
que les macrophages sont capables d'internaliser des antigènes
solubles depuis le milieu extracellulaire par un processus de macropinocytose,
conduisant les antigènes dans le cytosol. Les macrophages sont
également capables de présenter des antigènes exprimés
dans des bactéries Escherichia coli ou des salmonelles recombinantes
ou des antigènes dérivés du parasite intracellulaire
Leishmania major, en association à des molécules de classe
I.
III- TRANSPORT
DES MOLECULES DE CLASSE II ET FONCTION DE LA CHAINE INVARIANTE
Les molécules de classe II sont synthétisées
dans le réticulum endoplasmique, où s'associent trois dimères
ab avec un trimère de chaîne invariante
et les nonamères ainsi formés sont exportés vers
les endosomes via l'appareil de Golgi. La chaîne invariante est
une protéine chaperonne qui exerce plusieurs fonctions auprès
des molécules de classe II.
Tout d'abord, elle contribue à l'assemblage des chaînes a
et b nouvellement synthétisées
et assure leur stabilisation dans le réticulum sous une conformation
permettant leur transport vers la voie endocytique. Elle empêche
également la fixation de peptides endogènes, présents
dans le réticulum ou le réseau de Golgi, aux molécules
de classe II. De plus, des signaux localisés dans la région
cytoplasmique de la chaîne invariante sont responsables du transport
des molécules de classe II depuis le réticulum endoplasmique
vers la voie endocytique.
Au niveau des endosomes, la chaîne invariante est progressivement
dégradée par des protéases auxquelles résistent
les molécules de classe II. Quelques fragments peptidiques restent
temporairement associés aux dimères ab
de molécules de classe II. En particulier, différents peptides
de la région 81-104, appelés peptides CLIP (pour "class
II associated invariant chain peptides"), isolés lors de l'élution
des peptides naturels associés aux molécules de classe II,
sont associés au dimère ab et permettent d'empêcher
la fixation de peptides endogènes.
Deux modes d'interaction ont été envisagés pour les
peptides CLIP. D'une part, les motifs d'interaction de CLIP avec les molécules
de classe II sont semblables aux motifs des peptides ligands naturels
et cette interaction est modulée par le polymorphisme allélique
des molécules de classe II, ceci suggérant la fixation de
CLIP dans le sillon peptidique de la molécule de classe II. D'autre
part, la fixation d'autres peptides pourrait être inhibée
par un blocage allostérique exercé par CLIP. En fait, la
structure cristallographique de CLIP associé à la molécule
HLA-DR3 a révélé qu'il se fixe au niveau du sillon
peptidique de façon quasiment identique aux peptides antigéniques.
La protéolyse de la séquence correspondant à CLIP
permet de démasquer le site de liaison au peptide et supprime le
signal de rétention dans les endosomes pour le dimère ab,
qui peut alors s'associer à un peptide antigénique. La dissociation
entre la chaîne invariante et les molécules de classe II
dépend d'une part de l'activité protéolytique des
endosomes et d'autre part, de l'affinité de la chaîne invariante
pour les différents allèles des molécules de classe
II. L'étude de cellules B déficientes dans la présentation
d'antigènes exogènes et mutées dans les gènes
HLA-DM, situés dans la région des gènes des molécules
de classe II, a suggéré un rôle primordial des molécules
DM pour la liaison de peptides aux molécules de classe II. L'équivalent
de ces molécules DM a également été identifié
chez la souris et est appelé molécules H2-M. Des travaux
récents ont montré que les protéines DM catalysent
la dissociation de peptides déjà présents sur les
molécules de classe II, dont CLIP, permettant l'échange
de CLIP contre des peptides antigéniques. Ces résultats
sont confirmés par l'étude de souris n'exprimant plus les
molécules H2-M par des mutations au niveau des gènes codant
pour ces protéines. Les cellules spléniques de ces animaux
expriment à leur surface, des molécules de classe II stables,
auxquelles sont fixés surtout des peptides dérivés
de la chaîne invariante, et ces cellules ne sont pas, ou peu, capables
de présenter des protéines ou des peptides à des
cellules T. De plus, l'activité des molécules HLA-DM est
optimale dans un environnement acide (pH 5) correspondant au pH des vésicules
tardives ou Iysosomiales de la cellule, où sont générés
les peptides antigéniques.
IV- COMPARTIMENTS CELLULAIRES
IMPLIQUES DANS L'ASSOCIATION DES MOLECULES DE CLASSE II AU PEPTIDE ANTIGENIQUE
Les molécules de classe II associées à
la chaîne invariante sont transportées depuis le réticulum
endoplasmique, à travers le réseau golgien vers la voie
endocytique. Cependant, il n'y a pas à l'heure actuelle, de consensus
sur la distribution et le trafic des complexes classe II-chaîne
invariante parmi les différents compartiments de la voie endocytique,
que constituent schématiquement les endosomes précoces,
les endosomes tardifs et les lysosomes. La liaison de peptides aux molécules
de classe II a t-elle lieu dans un compartiment unique, ou au contraire
dans les différentes vésicules constituant la voie endocytique?
La notion d'un compartiment endocytique spécialisé dans
l'accumulation des molécules de classe II et où aurait lieu
leur rencontre avec les peptides antigéniques a été
initialement suggérée par une étude morphologique
et immunocytochimique d'une lignée Iymphoblastoïde B humaine.
Les molécules de classe II ont été révélées
dans un compartiment prélysosomal en absence de chaîne invariante,
mais elles n'ont pas été détectées dans les
endosomes précoces, suggérant un transport direct des molécules
de classe II vers cette vésicule. Par ailleurs, les molécules
de classe II ont été localisées dans les lysosomes
et les phagolysosomes de macrophages ayant capté des bactéries
Listeria monocytogenes par phagocytose. Les complexes peptide-classe II
ont également été retrouvés au niveau de prélysosomes
dans les macrophages.
Plus récemment, à l'aide de techniques de fractionnement
subcellulaire des vésicules de la voie endocytique, plusieurs études
analysant des cellules B ont mis en évidence un compartiment endocytique
spécialisé, appelé CIIV (vésicule de classe
II) où sont retrouvées les molécules de classe II
nouvellement synthétisées, associées de façon
stable à des peptides antigéniques. Les molécules
de classe II ayant perdu leur chaîne invariante dans les endosomes,
seuls des peptides de la région CLIP provenant de la chaîne
invariante ont été retrouvé associé aux molécules
de classe II dans ces compartiments CIIV. L'association de peptides antigéniques
aux molécules de classe II s'effectuerait dans ce compartiment,
différent des endosomes précoces, tardifs ou Iysosomaux,
auquel toutefois, les antigènes internalisés par endocytose
auraient accès.
Au contraire de ce compartiment spécialisé dans la liaison
peptide-classe II, une étude sur des lymphoblastes B spléniques
de souris a révélé la présence de complexes
classe II-chaîne invariante et de complexes classe II-peptide antigénique
dans diverses catégories de vésicules de la voie endocytique.
Cette étude suggère que la fixation du peptide aux molécules
de classe II peut s'effectuer tout au long du cheminement des molécules
de classe II depuis le réseau golgien dans la voie endocytique
en fonction du niveau de dégradation des antigènes dans
chaque compartiment.
Chaque molécule du CMH ayant chargé efficacement un peptide
antigénique, quitte le compartiment où ce complexe s'est
formé puis est transporté vers la membrane plasmique par
un mécanisme d'exocytose non encore exploré, pour être
reconnu par les lymphocytes T spécifiques.

Dégradation et transport de l'antigène qui fixe les
molécules de classe II
V- LES CELLULES SPECIALISEES DANS LA PRESENTATION
DE L'ANTIGENE , RESTREINTE PAR LES MOLECULES DE CLASSE II DU CMH
Les antigènes exogènes sont captés
dans le milieu extracellulaire et transportés au sein de la cellule
selon un processus d'endocytose. La substance à ingérer
(protéine, micro-organisme ou débris cellulaire) est incluse
dans une invagination de la membrane plasmique qui se détache pour
former une vésicule intracellulaire, appelée endosome. La
voie endocytique est composée d'une suite de vésicules,
caractérisée par une acidité croissante depuis la
membrane plasmique vers le centre de la cellule et contenant une grande
variété d'enzymes protéolytiques impliquées
dans la dégradation de l'antigène. On distingue schématiquement,
les endosomes précoces (pH 6,5-5,5), les endosomes tardifs (pH
5) et les lysosomes (pH 4,5). Les endosomes précoces représentent
les compartiments où les molécules à recycler vers
la surface des cellules sont séparées de celles qui sont
transportées vers les compartiments tardifs. Nous décrirons
les principales voies d'endocytose utilisées pour la capture d'un
antigène par une cellule présentatrice.
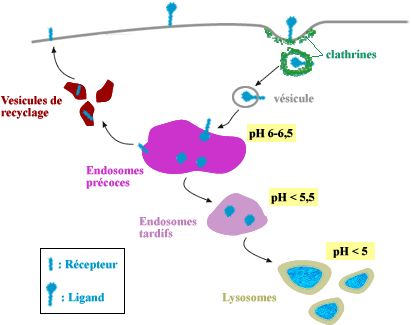
Organisation fonctionnelle de la voie endocytique
Une cellule présentant un déterminant
antigénique à une cellule T, CD4 +, doit satisfaire à
plusieurs critères:
1) être capable de capturer une substance antigénique par
l'un des processus mentionnés précédemment,
2) synthétiser des molécules du CMH de classe II,
3) pouvoir dégrader l'antigène en fragments peptidiques
et,
4) exprimer les molécules de co-stimulation nécessaires
à l'activation complète des cellules T.
L'ensemble de ces conditions sont réunies par certains types de
cellules appartenant au système immunitaire, appelés cellules
présentatrices de l'antigène spécialisées.
Ce sont essentiellement les monocytes et les macrophages, les cellules
dendritiques et les lymphocytes B qui expriment de façon constitutive
les molécules de classe II du CMH.
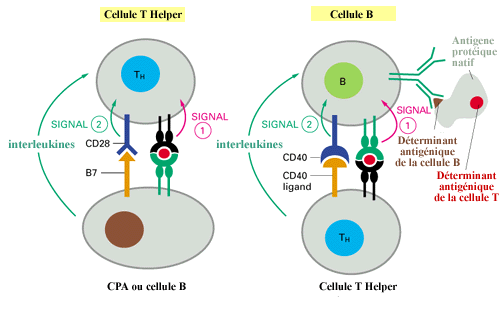
Exemple de présentation de peptide sur le CMH II par des CPA
ou des LB conduisant à l'activation du LThelper ou du
LB
Néanmoins, d'autres cellules sont capables de
présenter un antigène en association avec les molécules
de classe II du CMH. Ces types cellulaires peuvent être associés
à des spécificités tissulaires particulières,
comme les cellules épithéliales de l'intestin capables de
présenter des peptides ou des protéines, les kératinocytes
de l’épiderme , les hépatocytes au niveau du foie,
les astrocytes et les cellules de la microglie dans le système
nerveux central. D'autres cellules deviennent capables d'activer des lymphocytes
T en cas de pathologies, comme les polynucléaires éosinophiles
au cours de manifestations allergiques. Les mastocytes différenciés
à partir de cellules de la moelle osseuse de souris ont aussi la
propriété de stimuler des cellules T de façon spécifique
de l'antigène. Les lymphocytes T humains sont également
capables de présenter des antigènes solubles tels que la
protéine gp120 du virus de l'immunodéficience humaine (VIH)
ou la protéine d'enveloppe du virus de l'hépatite B (VHB),
grâce à l'endocytose de ces antigènes par des récepteurs
spécifiques présents à la surface des cellules T.
Les lymphocytes T humains exerceraient également un rôle
de CPA, après une activation permettant un niveau d'expression
suffisant des molécules du CMH de classe II et de co-stimulation,
comme par exemple, après la stimulation de clones T alloréactifs
en présence d'IL-2 et de CPA allogéniques, préalablement
à la présentation de la toxine tétanique à
des clones T spécifiques.
A - Les macrophages
Les monocytes originaires de la moelle osseuse sont immatures,
ils circulent dans le sang, d'où ils peuvent migrer vers les organes
et tissus de l'organisme, où ils deviennent alors des macrophages
différenciés. Ces macrophages sont distribués dans
tout l'organisme, comme le foie (appelées alors cellules de Kupfer),
la rate, les ganglions lymphatiques, le cerveau, les poumons, les cavités
séreuses (pleurale et péritonéale), le tractus gastro-intestinal,
etc. Ils expriment de façon constitutive les molécules de
classe II du CMH et possèdent une activité phagocytaire
très importante qui leur permet d'ingérer des micro-organismes
ou des débris cellulaires. L'efficacité d'internalisation
de substances antigéniques peut être modulée par le
ciblage d'antigènes vers des récepteurs présents
à la surface des macrophages, qui permettent par conséquent
d'accroître l'efficacité de présentation de déterminants
antigéniques. Parmi ces nombreux récepteurs, nous pouvons
citer les récepteurs pour le fragment Fc des immunoglobulines G
(RFcg), les récepteurs de polysaccharides (par exemple, le mannose)
reconnaissant les glycoprotéines des agents microbiens et les récepteurs
pour les protéines de la famille des a2-macroglobulines ayant la
propriété de fixer covalement d'autres protéines
lors de changement conformationnel induit par des enzymes, comme les récepteurs
pour les fragments C3 ou C4 du complément.

Exemple de récepteurs pour le fragment Fc des immunoglobulines
G (RFcg)
Il existe plusieurs types de RFcg, dits de haute ou de
faible affinité. Les récepteurs de haute affinité,
RFcgI, ne semblent pas jouer un rôle prépondérant
dans l'internalisation de l'antigène sous forme de complexes immuns
antigène-anticorps, au contraire des récepteurs de faible
affinité RFcgII et RFcgIII. Toutefois, il faut distinguer l'isotype
RFcgIIb2, exprimé par les monocytes et macrophages de l'isotype
RFcgIIbl, exprimé par les lymphocytes B et ne permettant pas la
présentation d'antigène aux lymphocytes T. La capture de
complexes immuns par l'intermédiaire de RFc permet notamment la
présentation d'un antigène complexe par sa structure quaternaire,
l'hormone chorionique gonadotropique (hCG), à des cellules T spécifiques.
B - Les cellules dendritiques
Les cellules dendritiques, comme les macrophages proviennent de la lignée
myéloïde. Les précurseurs issus de la moelle osseuse
sont libérés dans la circulation sanguine et distribués
dans de nombreux tissus non lymphoïdes, par exemple au niveau de
l'épiderme, sous le nom de cellules de Langerhans. Après
avoir capté un antigène, elles sont ensuite capables de
migrer vers les zones T des organes lymphoïdes pour activer les cellules
T spécifiques de l'antigène.
Les cellules dendritiques sont impliquées aussi bien dans la présentation
d'antigènes aux cellules T, CD4 + restreintes par les molécules
de classe II que dans l'induction de cellules cytotoxiques, restreintes
par les molécules de classe I, notamment pour des antigènes
d'origine tumorale. L'excellente efficacité de présentation
de l'antigène par les cellules dendritiques est attribuée
notamment au niveau d'expression élevé des molécules
de classe I et Il du CMH et de molécules de co-stimulation à
leur surface. D'autre part, elles sont capables d'internaliser des antigènes
par différentes voies efficaces d'endocytose, telles que la pinocytose
en phase liquide, l'endocytose médiée par récepteur
tels que le RFc ou le récepteur mannose. Leur capacité à
phagocyter des antigènes particulaires reste assez controversée,
et ceci pourrait s'expliquer par la très grande hétérogénéité
morphologique et fonctionnelle de ces cellules en fonction de leur état
de différenciation, en particulier après les multiples étapes
nécessaires à leur isolement et leur culture in vitro. Ainsi,
rapidement après leur isolement de la peau, les cellules de Langerhans
sont capables de phagocyter des levures, des bactéries ou des particules
de latex de 0,5 à 3 mm. Cependant, cette activité phagocytaire
est fortement diminuée au cours de la maturation des cellules in
vitro, tandis qu'elles acquièrent des propriétés
de co-stimulation importantes. Par ailleurs, des précurseurs de
cellules dendritiques issus de moelle osseuse phagocytent des bactéries
comme le BCG ou des particules de latex de 2 mm alors que des cellules
dendritiques provenant de thymus ou de sang périphérique
humain sont incapables de phagocyter des micro-organismes tels que BCG,
Candida albicans ou des particules de latex. La capacité de capture
de l'antigène semble également régulée par
les cytokines employées in vitro pour la culture des cellules dendritiques
isolées d'un organisme. En effet, la culture de cellules mononuclées
humaines CD19-, CD2- provenant du sang périphérique en présence
de GM-CSF et d'IL-4 leur confère la capacité d'internaliser
des substances exogènes par un processus de macropinocytose. Toutefois,
la rencontre avec un antigène engendre une maturation des cellules
dendritiques conduisant à la diminution de leur capacité
à capter des antigènes, au profit d'une meilleure aptitude
à présenter des antigènes.
C - Les Lymphocytes B
Les lymphocytes B, tout comme les macrophages, sont assez peu efficaces
pour la capture d'antigènes par micro pinocytose en phase liquide.
Cependant, les cellules B peuvent fixer les antigènes grâce
à leurs immunoglobulines de surface (IgM). La spécificité
de l'IgM pour un antigène donné permet de concentrer cet
antigène et de le présenter aux cellules T à des
doses 1000 fois inférieures à celles nécessaires
pour activer les lymphocytes T avec des cellules B non-spécifiques
de l'antigène. Les IgM sont continuellement internalisées,
qu'elles soient liées ou non à un antigène. Lorsqu'une
IgM fixe l'antigène qui lui est spécifique en surface du
lymphocyte B, elle permet le transport de cet antigène vers les
compartiments endosomaux et lysosomaux de la cellule B où l'antigène
est dégradé en fragments peptidiques présentés
aux cellules T auxiliaires. Ce processus est essentiel pour l’interaction
entre les cellules T et B conduisant à l’activation et à
la différenciation des cellules B en cellules productrices d’anticorps.
BIBLIOGRAPHIE:
1. Williams, O.B., and Watts, T .H. 1995. Molecular chaperones
in antigen presentation. Curr. Op. Immunol., 7, 77.
2. Rammensee, H.G. 1995. Chemistry of peptides associated with MHC class
1 and class Il molecules. Curr. Op. Immunol., 7, 85.
3. Pinet, V., and Eliaou, J.F. 1995. HLA-OM ou comment rendre les molécules
HLA de classe II présentables. Méd./ Sci., 1 1, 747.
4. Howard, J.C. 1995 Supply and transport of peptides presented by class
1 MHC molecules. Curr. Op. Immunol., 7, 69.
5. Stroynowski, 1., and Forman, J. 1995. Novel molecules related to MHC
antigens. Curr. Op. Immunol., 7,97.
6. Viville, S., and Rabourdin-Combe, C. 1994. La chaîne invariante:
son rôle et sa fonction dans la réponse immunitaire spécifique.
Méd./ Sci., 1O, 163.
7. Sinigaglia, F., and Hammer, J. 1994. Oefining ru les for the peptide-MHC
class Il interaction. Curr. Op. Immunol., 6,52.
8. Bahram, S. 1993. Transporteurs de peptides et présentation de
l'antigène. Méd./Sci., 9, 1204.
|