APPRETAGE ET PRESENTATION DES ANTIGENES DANS LE
CONTEXTE CMH DE CLASSE I
d'après le cours du Dr. François
Lemonnier
I- INTRODUCTION
Le complexe majeur d’histocompatibilité
(CMH) appelé HLA chez l’homme, H-2 chez la souris, comporte
trois classes de gènes:
- Les gènes de classe I codent la chaîne
a (chaîne lourde) des molécules
d’histocompatibilité de classe I. Ces chaînes lourdes,
associées à la b2-microglobuline,
sont reconnues par les lymphocytes T CD8+, le plus souvent cytotoxiques.
Les produits des loci HLA-A, -B, ou -C et H-2K, -D ou -L se différencient
des produits des autres gènes de classe I par leur expression quasi
ubiquitaire et leur grand polymorphisme allélique. Ces deux caractéristiques
rendent compte de leur utilisation prévalente par les lymphocytes
T cytotoxiques.

Les loci Humain HLA-A, B et C sont situé sur le chromosome
6, en aval des gènes de classe II
- Les gènes de classe II codent
les la chaîne a et b
des molécules d’histocompatibilité de classe II. Ces
molécules, également très polymorphes, sont d’expression
restreinte à certains types de cellules (monocytes, lymphocytes
B). Elles sont reconnues par les lymphocytes T CD4+, le plus souvent amplificateurs
et non cytotoxiques. Elles assurent principalement la présentation
des antigènes exogènes, par exemple celle de protéines
injectées.
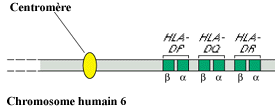 Les loci Humain HLA-DP, DQ et DR sont situé sur le chromosome
6, en amont des gènes de classe I
Les loci Humain HLA-DP, DQ et DR sont situé sur le chromosome
6, en amont des gènes de classe I - Les gènes de classe III forment
un ensemble hétérogène comportant des gènes
sans relevance immunologique (gène de l’hydrolase en 21 des
hormones stéroïdiennes par exemple et des gènes d’intérêt
immunologique direct (C4A, C4B, TNF, gènes codant les deux sous-unités
TAP 1, TAP 2 des pompes à peptides associés à la
présentation antigénique par les molécules d’histocompatibilité
de classe I, gènes codant certaines sous- unités LMP-2,
LMP-7 du protéasome.
II- PRESENTATION ANTIGENIOUE PAR LA MOLECULE D’HISTOCOMPATIBILITE
DE CLASSE I
A - La molécule d’histocompatibilité
de classe I
Elle résulte de l’association de 3 éléments:
la chaîne lourde, la b2-microglobuline
et un court peptide de 8 à 10 acides aminés. b2-microglobuline
et peptide sont nécessaires à la stabilisation de la molécule
et à sa migration vers la surface cellulaire.
La structure tridimensionnelle de la molécule d’histo-compatibilité
est maintenant bien connue. Cette molécule comporte 2 parties:
un "pied", formé par le 3ème domaine de la chaîne
lourde surmonté de la b2-microglobuline;
ce pied assure la connexion avec la portion intracellulaire courte de
la molécule, il supporte à son autre extrémité
la "tête" de la molécule qui est formée
des domaines al et a2
de la chaîne lourde.

Vue schématique d'une molécule de CMH I
Les domaines al et a2
forment un plateau constitué par le rapprochement de 8 plis b
anti-parallèles. Ce plateau est surmonté de deux hélices
a. Plateau et hélices délimitent
une grotte de 25 Å de long et 10 Å de large au niveau de laquelle
se fixent les peptides qui seront présentés au système
immunitaire.
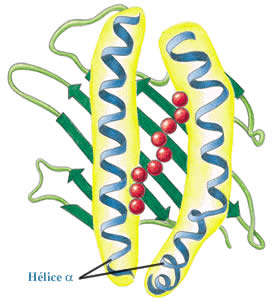
Peptide fixé dans la "grotte"
Il est important de noter que cette grotte est fermée
à ses deux extrémités et que l’essentiel des
résidus polymorphes, ceux qui différencient les allèles,
se regroupent au niveau de cette grotte, soit sur le plancher, soit sur
la face interne des hélices a. Ces résidus
polymorphes délimitent des "poches" (6 dans le cas de
HLA-B27 par exemple) de structure variable et qui doivent accommoder les
extrémités NH2 et COOH terminales et les chaînes latérales
des peptides fixés. Le jeu de peptides fixés par un allèle
diffère donc du jeu de peptides fixés par un autre allèle.
B - Six Postulats
- La charge des peptides par les molécules d’histocompatibilité
de classe I est un phénomène passif résultant de
la simple diffusion de ces peptides dans le réticulum endoplasmique.
- Les molécules d’histocompatibilité fixent des peptides
courts (de 8 à 10 acides aminés), lorsqu’ils ont les
rédidus d’ancrage appropriés à l’allèle
interactif.
Ces assertions sont toutes excessives, soit qu’elles simplifient
la réalité biologique, soit qu’elles présentent
comme établies des hypothèses encore incomplètement
testées. Nous les considérerons successivement dans la suite
de cet exposé, afin de mieux cerner dans chaque cas les limites
entre ce qui est démontré et ce qui ne l’est pas.

Exemple d'une présentation d'un peptide viral au cellule T
cytotoxique via une molécule de CMH I
1 - Origine endogène exclusive des peptides
présentés par les molécules d ‘histocompatibilité
de classe I (1-4)
Dans l’ensemble, cette assertion se vérifie mais avec une
exception majeure, la cellule dendritique. Par exemple, l’injection
d’une protéine (KLH) à une souris induit une réponse
lymphocytaire T proliférative et la production d’anticorps
(surtout si la KLH a été couplée à un haptène)
mais ne stimule pas le secteur lymphocytaire CD8+. A l’inverse,
l’inoculation de cellules lymphocytaires de souris mâles à
une souris syngénique (dont la naissance est commune, de lignée
pure) femelle induit une réponse cytotoxique T CD8+ mais ne stimule
pas la production d’anticorps.
Des exceptions à cette règle viennent cependant d’être
rapportées. Prenons le cas de l’ovalbumine. Si de l’ovalbumine
est injectée à une souris, on induit une réponse
proliférative, pas ou très peu de réponse cytotoxique.
Si les cellules spléniques du même animal sont incubées
in vitro avec cette même ovalbumine puis réinjectées
à cette souris, celle-ci développera lors d’une stimulation
de rappel ultérieure de puissantes réponses cytotoxiques
restreintes par la molécule d’histocompatibilité de
classe I et spécifiques de l’ovalbumine. Des observations
analogues ont été faites avec d’autres molécules,
par exemple la transcriptase reverse du VIH. L’introduction de peptides
immunogéniques pour les lymphocytes T cytotoxiques dans des molécules
susceptibles de pénétrer dans le cytosol (certaines toxines
bactériennes par exemple) ou l’expression de ces peptides
par des micro- organismes (Listéria monocytogènes, BCG)
dont le cycle réplicatif comporte une étape intracellulaire,
permet d’induire de bonnes réponses CTL.
Il a été observé pour différentes protéines
(glycoprotéine d’enveloppe du virus LCMV, nucléoprotéine
du VSV) que leur dénaturation (chauffage, SDS) préalable
à leur injection favorise l’induction de réponses
cytotoxiques, tout comme leur inclusion dans des structures particulaires
(Ty de levure, particules pseudovirales, adsorption de ces protéines
sur des billes de latex).
Par un mécanisme comparable, les antigènes inclus dans les
corps apoptotiques dérivant d’une cellule sont efficacement
présentés aux lymphocytes T cytotoxiques.
La cellule dendritique est pour l’essentiel responsable de la présentation
de ces antigènes particulaires grâce à sa capacité
de macropinocytose avec adressage dans le cytosol d’une partie des
antigènes ingérés.
2 - Dégradation exclusivement cytosolique
La dégradation cytosolique d’antigènes présentés
par les molécules d’histocompatibilité de classe I
a été établie par A. Townsend. Il a observé
que lors d’une infection par le virus grippal, une large fraction
des cellules cytotoxiques reconnaissait la nucléoprotéine
virale qui n’est pas exprimée à la surface mais dans
le cytosol des cellules infectées. Cette observation a été
confirmée dans de nombreux systèmes, certains, que l’on
peut subdiviser en 2 sous-groupes, plus intéressants que les autres
car ayant résulté de manipulations de déroutage antigénique.
Dans le premier sous-groupe, par excision de la séquence signal,
des molécules (hémagglutinines du virus grippal, molécule
HLA-Cw3) sont adressées dans le cytosol et non, comme à
l’état naturel, à la membrane plasmique. Néanmoins,
dans les deux cas, les cellules exprimant ces protéines détournées
continuent de présenter efficacement les mêmes peptides immunogènes.
Le second sous-groupe correspond à un déroutage antigénique
par pinocytose forcée. La pinocytose d’ovalbumine en milieu
hyperosmotique suivie d’un choc hypo-osmotique modéré
et bref assure la pénétration cytosolique de l’ovalbumine
et, une heure plus tard, les cellules ainsi traitées présentent
à leur surface les peptides immunogéniques de cet antigène
associés à leurs molécules d’histocompatibilité
de classe I.
Il est donc bien établi qu’une protéine adressée
dans le cytosol est dégradée et présentée
efficacement par les molécules d’histocompatibilité
de classe I. Est-ce suffisant pour affirmer que le cytosol est le site
de dégradation unique donnant accès à la présentation
restreinte par les molécules d’histocompatibilité
de classe I ? Certainement non.
De façon très récente, il a été observé
que des molécules d’histocompatibilité de classe I
pouvaient présenter des peptides produits dans le réticulum
endoplasmique par la signal peptidase, et correspondant aux séquences
hydrophobes d’adressage vers le réticulum des protéines
exportées. La phagocytose de bactéries exprimant l’ovalbumine
aboutit à la stimulation de CTL : cette stimulation peut être
est inhibée par la chloroquine (qui élève le pH des
endosomes et du lysosome),mais pas par la bréfeldine (qui bloque
l’export des protéines du réticulum endoplasmique
vers le Golgi). La charge des molécules de classe I est donc dans
ce cas dépendante de l’activité des protéases
lysosomiales (ou cathepsines). Ces observations illustrent le caractère
opportuniste de la présentation antigénique par les molécules
de classe I et l’utilisation possible pour cette présentation
de plusieurs systèmes protéasiques.
Il a de même été proposé que des protéases
associées aux compartiments excréto-sécrétoires
(réticulum endoplasmique, Golgi) pouvaient assurer un apprêtage
efficace des protéines adressées dans ces compartiments
cellulaires. En effet, l’expression dans ces compartiments de la
glycoprotéine d’enveloppe du VIH par des cellules déficientes
en activité TAP (voir ci-après) est suivie d’une présentation
efficace de peptides aux lymphocytes cytolytiques par les molécules
d’histocompatibilité de classe I. Il vient d’être
établi que des peptides transloqués dans le réticulum
endoplasmique par les pompes TAP avec une extension amino-terminale ne
permettant pas leur fixation efficace aux molécules d’histocompatibilité
de classe I subissaient un élagage de cette extension amino-terminale
par des amino-peptidases zinc-dépendantes dans ce compartiment
cellulaire. A l’inverse, aucune possibilité d’élagage
de l’extrémité C- terminale ne semble exister dans
le réticulum endoplasmique. Il est cependant clair que les capacités
d’apprêtage du réticulum endoplasmique et du Golgi
sont limitées. Ainsi, ces protéases putatives ne permettent
pas l’apprêtage efficace d’autres molécules (glycoprotéine
du virus de la rougeole, glycoprotéines cellulaires sécrétées
ou exprimées à la membrane plasmique). Il semble donc raisonnable
de considérer le cytosol comme le site privilégié
de production peptidique. Dans la mesure où l’ensemble des
molécules produites par une cellule peuvent être efficacement
apprêtées et présentées aux lymphocytes cytolytiques,
quel que soit le compartiment cellulaire dans lequel elles sont adressées
(mitochondrie, noyau, voie excréto-sécrétoire), on
est conduit à postuler des mécanismes d’acheminement
de retour vers le cytosol (avec implication de molécules chaperonnes)
ou a concevoir que l’apprêtage et la présentation peptidique
par les molécules d ‘histocompatibilité de classe
I résultent de la dégradation d’une fraction de protéines
imparfaitement synthétisées par les ribosomes. Il vient
ainsi d’être démontré par étude de cellules
infectées par le cytomégalovirus humain que la dégradation
de protéines HLA de classe I (moyen développé par
ce virus pour échapper aux CTL) adressées dans le réticulum
endoplasmique était effectuée dans le cytosol, deux des
protéines du virus (analogues à Sec 61 et associées
au canal d’exportation des protéines vers le réticulum
endoplasmique) assurant ce transport rétrograde, rapidement suivi
d’une déglycosylation par une N-glycanase cytosolique.
3 - Présentation antigénique par
les molécules d’histocompatibilité de classe I et
protéolyse dépendante de l’ubiquitine (11 - 15)
La dégradation d’une protéine par la voie de l’ubiquitine
dépend de la fixation, sur une même molécule, de plusieurs
ubiquitines, la mono-ubiquitinilation étant un processus réversible.
Cette fixation est aussi dépendante de la protéine elle-même:
des protéines modifiées par oxydation, ou porteuses de séquence
PEST ou ayant en situation NH2 terminale un acide aminé basique
ou hydrophobe ("N end rule") sont, en général,
de bons substrats pour l’UCDEN et tendent, en conséquence,
à être rapidement dégradées.
Cette fixation est assurée par un complexe multimérique
de dégradation, l’UCDEN (Ubiquitin Conjugate Degrating Enzyme)
de 1500 Kd.
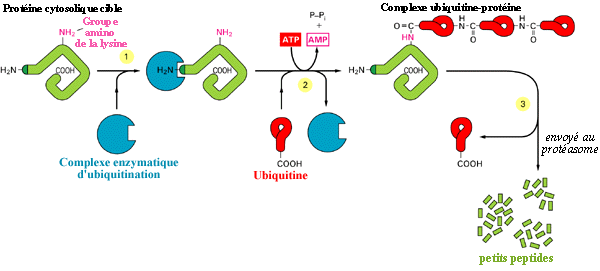
Le processus d'ubiquitination
L’UCDEN est formé de 3 sous-unités:
CF1, CF2, CF3 qui peuvent s’associer et se dissocier de manière
contrôlée (ATP Mg++). CF3 (650 Kd) est encore connu sous
les noms de protéasome, de multicatalytic enzyme, de macropaïne.
Le protéasome est formé de 13 à 20 sous-unités
différentes, on le trouve surtout dans le cytosol, au niveau des
nucléoles, certaines sous-unités seraient aussi à
la surface cellulaire.
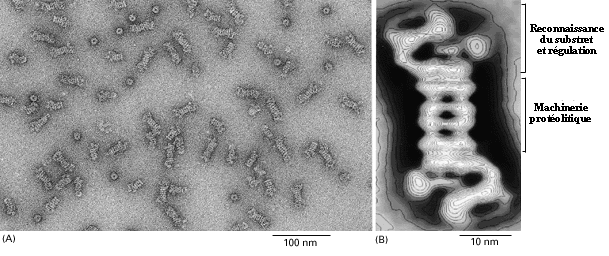
(A) De nombreuses particules de protéasome (B) Un modèle
3D d'un seul complexe de protéasome
(Electron micrographs courtesy of Wolfgang Baumeister, from J.M. Peters
et al.
J. Mol Biol. 234: 932_937, 1993.)
Le protéasome est une structure commune à
toutes les cellules eucaryotiques. Il est philogénétiquement
très conservé. On associe au protéasome deux fonctions
:
Il inhiberait spécifiquement la traduction de certains ARN messagers,
le protéasome étant un complexe ribonucléoprotéique,
les courts ARN qui lui sont associés conféreraient à
ce blocage sa spécificité.
Il est également capable d’activité endopeptidasique
et trois sites catalytiques distincts de type trysique (post-arginine)
, chymotrysique (post-leucine) et post-glutamique lui sont associés.
Un grand nombre d’arguments supportent la possibilité que
l’UCDEN soit responsable de la production des peptides envoyés
dans le réticulum endoplasmique et éventuellement fixés
par les molécules d’histocompatibilité de classe I
:
- les gènes LMP2, LMP7 et LMP10 qui participent à la formation
du protéasome, sont retrouvés en abondance sur la face cytosolique
du réticulum endoplasmique, et sont inductibles par le g interféron;
- l’étude des peptides produits par des protéasomes
isolés de cellules LMP2 négatives, de cellules normales
traitées par de l’interféron ou de cellules normales
non traitées, révèle de substantielles différences
à la fois qualitatives et quantitatives;
- il semble de la même manière, que des souris recombinantes
négatives pour le gène LMP2, présentent moins de
peptides associés à leurs molécules de classe I que
les souris contrôle;
- enfin, la présentation par les molécules de classe I de
peptides dérivant de l’ovalbumine, suite à leur internalisation
forcée, par pinocytose osmotique, est déficiente dans le
cas de cellules incapables d’activer la voie de l’ubiquitine
ou peut être inhibée par des drogues bloquant l’un
des sites catalytiques du protéasome.
Ces données n’excluent pas cependant l’existence de
voies alternatives. Tout d’abord certaines protéines (ornithine
décarboxylase, V- Jun) sont dégradées par l’UCDEN
sans avoir été ubiquitinées. Il est également
possible que d’autres protéases cytosoliques puissent se
substituer, dans certains cas, à l’UCDEN. Il a été
rapporté récemment que des cellules, traitées de
manière prolongée par des drogues inhibant le protéasome,
survivaient à ce traitement et restaient capables d’assurer
une présentation antigénique aux T cytotoxiques. Il n’est
enfin pas sûr que les protéases cytosoliques, même
dans le cas où leur implication est établie (ovalbumine
introduite par pinocytose par exemple), soient les seules protéases
impliquées. On peut concevoir en particulier que ces endoprotéases
donneraient, par clivage interne, naissance à des pro-peptides
le plus souvent impropres à un transport efficace vers le réticulum,
par exemple parce que trop longs, mais qui pourraient le devenir par action
subséquente d’exoprotéases cytosoliques.
Il faut enfin souligner que les variations de jeux peptidiques produites
par le protéasome 26S basal et l’immunoprotéasome
(incluant LMP2, LMP7 et LMP10) suite à la production d’interféron
et favorisant les coupures après les résidus hydrophobes,
peuvent dans certains cas prévenir la présentation de certains
épitopes, une donnée à prendre en considération,
surtout dans le cadre d’immunothérapie antitumorale avec
un nombre de peptides épitopiques candidats limité.
4 - Les peptides de classe I produits dans le
cytosol sont acheminés dans le réticulum endoplasmique par
les pompes à peptides associées au CMH
Ces pompes ont été découvertes grâce à
l’analyse de cellules mutantes (RMA-S chez la souris, T2 chez l’homme)
obtenues en contre-sélectionnant pour l’expression des molécules
d’histocompatibilité de classe I. Il se trouve que cette
expression réduite contraste avec une production intracellulaire
normale qualitativement et quantitativement de chaînes lourdes et
de b2-microglobuline, et que l’incubation
de ces cellules mutantes avec des peptides appropriés (susceptibles
de se fixer à leurs allèles de classe I) restaure partiellement
l’expression de surface de ces molécules. Par analyse de
ces cellules (fusion intercellulaire, caryotype) il a été
conclu (cellules T2) que le défaut d’expression des molécules
HLA de classe I était lié à la perte de gènes
situés dans la région HLA-D. Parallèlement à
ces travaux, deux groupes ont isolé certains des gènes de
classe III du CMH. L’analyse de ces gènes a mis en évidence
que deux d’entre eux avaient une structure comparable (site de fixation
de l’ATP, multiples segments transmembranaires, homologies de séquence)
à celle d’une famille de transporteurs transmembranaires.
A cette famille, appartiennent les gènes du canal Cl -
déficient chez les patients atteints de mucoviscidose, les gènes
codant la protéine mdr (multidrug resistance) et un gène
bactérien de salmonelle assurant les transports de peptides. Les
gènes des pompes à peptides associés au CMH ont donc
été utilisés pour corriger, par transfection, le
défaut d’expression des mutants RMA-S et T2. Cette correction
a été obtenue; elle a nécessité, selon les
cas, l’un ou l’autre, voire les deux gènes. L’analyse
du gène TAP2 des cellules RMA-S révélé l’existence
d’un codon stop prématuré introduit par mutation;
la fonction de présentation des cellules RMA-S est complètement
restaurée par un ADN complémentaire TAP2.
L’analyse des caractéristiques fonctionnelles de ces pompes
a été possible au cours de ces deux dernières années
par utilisation de cellules semi-perméabilisées par la streptolysine
O. Ces cellules peuvent être chargées en peptides iodés
(au niveau d’une tyrosine) et dont la glycosylation (sur un résidu
asparagine) témoigne d’un transport efficace dans le réticulum
endoplasmique. Cette approche a permis d’établir que les
pompes TAP sélectionnent des peptides de 8 à 16 acides aminés.
Elles transportent préférentiellement des peptides se terminant
par un résidu hydrophobe (leucine, isoleucine) et par un résidu
basique (dans le seul cas des pompes TAP humaines et des allèles
A chez le rat). Peu de contraintes semblent exister en ce qui concerne
les acides aminés internes, ce qui conduit à concevoir que
les peptides interagissent avec les pompes TAP par des liaisons hydrogène
impliquant la chaîne polypeptidique principale. Suite à cette
interaction, un changement conformationnel, dépendant de la consommation
d’ATP, permettrait leur transport dans le réticulum endoplasmique.
Il convient cependant de noter que certains peptides, de longueur et d’extrémité
COOH propice au transport, ne sont pas efficacement exportés et
que le niveau de restriction, lié à la sélectivité
des pompes TAP, de la présentation antigénique par les molécules
d’histocompatibilité de classe I, reste à évaluer.
Il semble d’autre part que certaines protéines du choc thermique
(les Hsp 70) assurent, dans le cytosol, la liaison entre protéasome
et pompe TAP, fixant les peptides produits par le premier pour les amener
aux pompes.
5 - Association de peptides aux molécules
d’histocompatibilité dans le réticulum endoplasmique
: processus passif ? (21- 23 )
On pourrait concevoir que cette association obéisse à des
règles simples d’interactions entre 3 ligands. La chaîne
lourde pourrait par exemple interagir d’abord avec la b2-microglobuline
mais cette interaction, généralement instable, ne deviendrait
définitive qu’après la fixation d’un peptide,
cette stabilisation autorisant la sortie de la molécule vers le
cis-golgi et la surface cellulaire. Dans ce modèle, les concentrations
relatives des trois partenaires seraient les seuls facteurs limitants,
la fixation peptidique serait sous la seule dépendance de la chaîne
lourde d’histocompatibilité, seule chaîne à
former le site de fixation peptidique. Si ce modèle était
correct, on s’attendrait, lors d’expériences de dissociation-réassociation
in vitro, à ce que l’efficacité de cette reconstitution
de molécules d’histocompatibilité de classe I soit
grande, tout au moins lorsque les conditions expérimentales sont
telles que les liaisons disulphures sont préservées. Ce
n’est pas le cas. Au mieux, 40% des molécules sont recomposées.
Nous savons d’autre part que, dans le réticulum, la chaîne
lourde interagit avec d’autres molécules (p88 ou calnexine,
calréticuline, tapasine, BIP). Ces molécules, porteuses
de séquences de rétention dans le réticulum endoplasmique
(KDEL) pourraient retenir (entre autres) les molécules d’histocompatibilité
jusqu’à ce qu’elles aient fixé des peptides.
Il semble en effet que tel soit le cas. La calréticuline s’associe
aux chaînes lourdes isolées. Après fixation de la
b2-microglobuline, le complexe chaîne
lourde b2-microglobuline, dépourvu de
peptide, est pris en charge par la calréticuline, puis, après
interaction avec la tapasine, ce complexe interagit avec la face luminale
des pompes TAP, jusqu’à fixation d’un peptide.
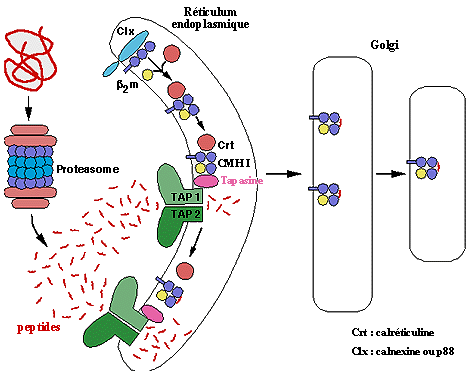
Modèle d'association de peptides aux molécules du CMH
I dans le R.E.
Cette interaction cesse après la fixation peptidique.
De manière alternative, il est possible que les peptides exportés
par les pompes TAP soient fixés dans le réticulum endoplasmique,
sur une molécule chaperonne Gp96, qui fait partie des protéines
induites par un choc thermique. Il a été démontré
qu’une activité peptidasique NH-2 terminale du réticulum
endoplasmique (non encore moléculairement identifié) assurait
la réduction de longueur des peptides transportés de taille
excessive pour une fixation efficace aux molécules d’histocompatibilité
de classe I.
6 - Règles de fixation dans la grotte
des molécules d’histocompatibilité de classe I
Elles sont déduites pour l’essentiel des travaux du groupe
de H. Ramensee. Après purification biochimique des molécules
d’histocompatibilité, élution acide des peptides,
séparation de ceux-ci par chromatographie, leur séquence
est définie par microséquençage.
L’extrémité NH2 terminale des peptides interagit avec
la poche A qui comporte 3 tyrosines conservées (7, 159 et 171)
permettant, par leur groupement hydroxyle, le développement de
liaisons hydrogène avec les groupements amine et carbonyle du premier
acide aminé du peptide. La chaîne latérale de ce premier
acide aminé, du fait de ces interactions, est donc nécessairement
orientée vers la sortie de la grotte. Cette observation cristallographique
est en accord avec les données biochimiques qui n’ont pas
révélé de biais, pour un acide aminé particulier,
à cette position.
L’extrémité COOH terminale du peptide interagit avec
la poche F. L’entrée de cette poche comporte des résidus
conservés (Tyr 84, Thr 143, Lys 146, Trp 147) qui développent
de nombreuses liaisons hydrogène avec les groupements carboxyle
terminal et carbonyle de l’avant dernier acide aminé du peptide.
La chaîne latérale du dernier acide aminé entre dans
la poche F, qui est le plus souvent très hydrophobe, ce qui rend
compte de la prédominance en position C terminale des résidus
leucine, isoleucine ou valine. Certains allèles (HLA-B27, RIT de
rat) ont un résidu acide aspartique, en position 116. Cet acide
aspartique est localisé dans la poche F. Ceci permet à ces
allèles de fixer des résidus dont la chaîne latérale
est chargée positivement (Arg), la charge positive étant
neutralisée par la création d’un pont salin avec le
groupement carboxyle chargé négativement de l’acide
aspartique.
Si les interactions des extrémités N et C terminales, en
raison des liaisons hydrogène ci-dessus détaillées,
imposent au peptide une orientation constante à l’intérieur
de la grotte, elles ne suffisent pas à une interaction stable.
Cette stabilisation est pour beaucoup assurée par le développement
de liaisons hydrogène entre, d’une part, les chaînes
latérales des acides aminés des faces latérales et
du plancher de la grotte, et, de l’autre, les groupements amines
et carbonyles des liaisons peptidiques de la chaîne principale du
peptide fixé. Ces liaisons font que le peptide est généralement
profondément enfoui dans la grotte. Dans la mesure où ces
liaisons se développent avec la chaîne atomique
principale du peptide (correspondant â la succession de liaisons
peptidiques), elles devraient être indépendantes de sa séquence
en acides aminés. Si tel était le cas, d’importantes
redondances devraient être observées entre les jeux de peptides
fixés par les différents allèles. Tel n’est
pas le cas.
Deux facteurs rendent compte de ce fait. Il est tout d’abord nécessaire
que la grotte de fixation peptidique puisse accommoder les chaînes
latérales du peptide fixé. Ces contraintes sont surtout
importantes pour les acides aminés de la moitié N terminale
du peptide. Elles sont donc largement dépendantes de la taille
des poches B et C et de la nature des résidus qui les forment.
Ainsi, les molécules H- 2Kd qui ont une poche B profonde, sélectionnent
des peptides ayant une tyrosine en position 2 (la chaîne latérale
aromatique de ce résidu se place dans la poche B). Inversement,
la petite poche B de la molécule H-2Kb rend compte du fait que
les acides aminés en position 2 des peptides associés à
cette molécule, ont une chaîne latérale courte (glycine,
alanine). La position S assure, dans ce cas, l’ancrage principal,
avec utilisation de la poche C. Moins de contraintes s’exercent
sur la moitié C terminale du peptide fixé, les interactions
entre les chaînes latérales du peptide fixé et les
molécules de classe Ise faisant souvent, à ces niveaux,
par l’intermédiaire de molécules d’eau. Il faut
enfin ajouter que des acides aminés à chaîne latérale
encombrante sont généralement retrouvés au niveau
des parois latérales de la poche de fixation peptidique, entre
les poches. L’encombrement stérique qui en résulte
limite également le jeu peptidique fixé par chaque allèle.
L’ensemble de ces contraintes fait que le peptide est fixé
aux molécules d’histocompatibilité dans une configuration
étendue, comportant le plus souvent un coude au niveau des troisième
et quatrième acides aminés, que la longueur habituelle est
de 9 résidus, et que les chaînes latérales des résidus
P1, P4, P5, P7, P8 sont, en théorie, accessibles au TCR. Ces règles
ne sont cependant pas très strictes. Des peptides avec une séquence
non consensuelle pour un allèle donné, sont parfois efficacement
présentés. Il est probable que le défaut d’ancrage
principal est alors compensé par les interactions des chaînes
latérales des résidus aux positions d’ancrage secondaire.
Des exemples de fixation de peptides, dont les séquences diffèrent
de la séquence canonique définie pour chaque allèle,
sont de plus en plus nombreux, certains étant même essentiels
à la défense efficace de l’organisme. Des peptides
d’une taille non consensuelle sont également présentés,
leur fixation étant permise par la formation d’un coude de
la chaîne peptidique principale avec extériorisation partielle
de la partie centrale du peptide fixé. Il semble même, mais
probablement de manière exceptionnelle, que certains peptides puissent
déborder côté C terminal de la poche peptidique. Une
approche purement prédictive des épitopes CD8 n’est
donc pas suffisante, parce qu’elle conduit à l’identification
de motifs dont un pourcentage élevé (jusqu’à
80%) ne sont pas immunogéniques, et parce qu’elle méconnaît
les peptides non consensuels.
III- INTERFERENCES VIRALES
Certains virus interfèrent avec le processus
de présentation antigénique par les molécules d’histocompatibilité
de classe I. Certains adénovirus répriment l’activité
transcriptionnelle des gènes codant les chaînes lourdes.
La protéine EBNA 1 du virus EBV comporte un segment NH2 terminal
riche en résidus basiques et qui semble prévenir sa dégradation
par le protéasome. Les virus Herpès 1 et 2 codent une protéine
ICP 47 qui se fixe sur la face cytosolique des pompes TAP et les bloque.
Le cytomégalovirus code pour une autre protéine qui simule
la fonction de la protéine US 11 analogue à SEC 61 et déroute
vers le cytosol les molécules d’histocompatibilité
où elles sont dégradées. La protéine E3, 19K
de certains adénovirus retient, elle, ces mêmes molécules
d’histocompatibilité dans le réticulum endoplasmique.
Enfin, la protéine NEF du VIH-1 accélère l’endocytose
des molécules d’histocompatibilité suite à
leur arrivée à la surface cellulaire.
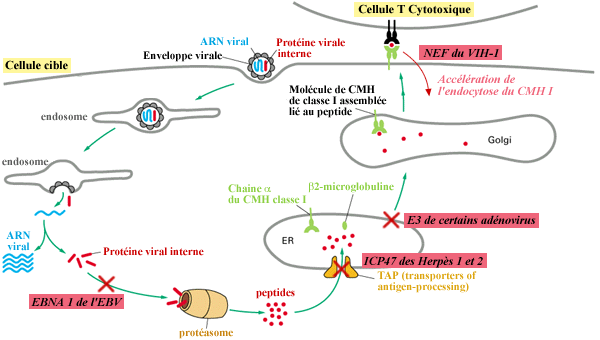
Exemple d'interférences virales
IV- CONCLUSIONS
Un triple intérêt s’attache à
l’étude des mécanismes de production et d’acheminement
intracellulaire des peptides destinés à être présentés
par les molécules d’histocompatibilité de classe I.
- Intérêt de biologie cellulaire tout d’abord, visant
à définir les mécanismes fondamentaux (protéases,
systèmes de transports intracellulaires) sur lesquels s’est
greffée la présentation peptidique par les molécules
d’histocompatibilité de classe I.
- Intérêt immunologique ensuite, car il est clair que ces
mécanismes ont des limites (certains peptides ne sont ni produits
ni efficacement transportés), ces limites s’ajoutent à
celles qui restreignent l’efficacité de l’étape
de fixation des peptides au niveau de la poche de présentation
et les prendre en compte devrait autoriser une prédiction plus
juste des séquences d’éventuel intérêt
vaccinal.
- Intérêt vaccinal enfin : si la définition exacte
des motifs fixés par les molécules d’histocompatibilité
amène à proposer d’utiliser des peptides synthétiques
dans un but vaccinal, cette possibilité se heurte à deux
ordres de difficulté. Financière, car le coût de ces
synthèses est très élevé. Inefficacité
relative, car la demi-vie de peptides injectés est courte et ils
n’ont pas accès au réticulum endoplasmique où
s’effectue l’essentiel de la charge des molécules d’histocompatibilité.
Diverses stratégies nouvelles sont en cours d’évaluation:
injection de structures particulaires (Ty, HBV), d’ADN intramusculaire
(vaccin à ADN), de protéines du choc thermique (Hsp 70,
Gp 76) chargées des peptides adéquats sans que l’on
puisse, à l’heure actuelle conclure quelle est la meilleure.
BIBLIOGRAPHIE:
1. J. Yewdell et al. 1988 Science 239, 637
2. U. Staerz et al. 1987 Nature 329, 449
3. F. Carbone and M. Bevan 1990 J. Exp. Med. 171, 377
4. M. F. Bachmann et al. 1994. Eur. J. Immunol. 24, 2128
5. A. Townsend et al. 1986 Cell 44, 959
6. A. Townsend et al. 1986 Nature 324, 575
7. G. Chimini et ai. 1989 J. Exp. Med. 169, 297
8. M. Moore et al. 1988 Cell 54, 777
9. R. Henderson et al. 1992 Science 255, 1264
10. M. Wei and P. Creswell1992 Nature 356, 443
11. D. Fruci et al 2001 Immunity 15, 467.
12. J. Drisscoll and A. Goldberg 1989 PNAS USA 86, 787
13. A. Bachmair and A. Varshavsky 1986 Science 234, 179
14. M. Brown et al. 1991 Nature 353, 355
15. K. Rock et al. 1994 Cell 78, 761
16. R. Glas 1998 Nature 292, 618
17. R. Glynne et al. 1991 Nature, 353, 357
18. Kelly et al. 1992 Nature, 355, 641
19. J. Monaco 1992 Immunol. Today 13, 173
20. F. Levy et al. 1991 Cell 67, 265
21. M. Silver et al. 1991 Nature 350, 619
22. F. Momburg et al. 1994 J. Exp. Med. 179, 1613
23. E. Degen and D. Williams 1991 J. Cell Biol. 112, 1099
24. B. Pérarnau et al. 1990 Nature 346, 751
25. B. Ortmann et al. 1994 Nature 368, 864
26. K. Falk. 1991 Nature 351, 290
27. J. Ruppert 1993 Cell 74, 929
28. D. Frémont et al. 1992 Science 257, 919
29. D. Mandoley 1991. Immunol. Today 12, 429
30. E. Wiertz 1996. Cell 84, 769
31. I. York 1994. Cell 77, 525
32. H.G. Burgert 1985. Cell 41, 987
33. O. Schwartz 1996. Nature Medecine 3, 338
34. F. Carbone et al. 1988 J. Exp. Med. 167, 1767
35. H. Schild et al. 1990 Science 247, 1587
36. H. Goumier et al. 1995 Eur. J. Immunol. 25, 2019. |
|