CYTOSQUELETTE:
TRANSPORT VIRAL et ALTERATIONS VIRO-lNDUITES
d'après le cours de Pierre-Emmanuel
CECCALDI, Unité de la Rage, Institut Pasteur.
INTRODUCTION
Le cytosquelette est un réseau complexe de filaments protéiques
s'étendant dans tout le cytoplasme, et organisant celui-ci, permettant
aux cellules eucaryotes de s'adapter à une grande variété
de changements morphologiques, d'effectuer des mouvements coordonnés.
Le cytosquelette est constitué de trois types de filaments protéiques:
les microfilaments d'actine (7 à 9 nm de diamètre),
les microtubules (25 nm de diamètre) et les
filaments intermédiaires (10 nm de diamètre).
Après quelques rappels sur ces structures, nous verrons dans
ce cours le rôle des différents éléments
du cytosquelette dans le cycle viral, plus spécialement dans
les phénomènes de transport viral, avant d'envisager différents
exemples d'altération du cytosquelette observés lors de
l'infection d'une cellule par un virus.

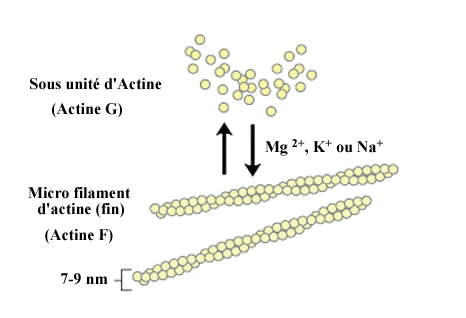
I- LES MICROFILAMENTS D'ACTINE
L'actine est la protéine intracellulaire
prépondérante dans la cellule eucaryote, et représente,
selon les types cellulaires, de 1 à 10% de la quantité
totale des protéines cellulaires, pour une concentration
dans le cytosol de l'ordre du millimolaire. Cette protéine de taille
moyenne (375 acides aminés) se présente dans la cellule
soit sous forme de monomère globulaire (actine G)
soit sous forme de polymère (actine F). Le microfilament
d'actine F, d'un diamètre de 7 à 9 nm, est une structure
polaire, avec une extrémité à croissance rapide (appelée
"+") et une extrémité à croissance lente
("-"). La polymérisation de l'actine G en micro filaments
d'actine F est amorcée par l'ajout d'ions Mg2+, K + ou Na+, selon
un processus réversible, l'actine F se dépolymérisant
quand on abaisse la force ionique de la solution. Dans la cellule, il
existe un équilibre dynamique entre la forme monomérique
(G) d'actine et la forme filamenteuse (F), le passage de l'actine G à
l'actine F étant régulé par des protéines
associées à l'actine, en réponse à différents
stimuli.
Le réseau d'actine est localisé d'une part juste
sous la membrane plasmique, où il constitue un maillage bi-dimensionnel
associé à la membrane, et au sein de la cellule, où
il constitue un réseau tri-dimensionnel conférant
un aspect gélatineux au cytosol. De nombreuses protéines
interagissant avec l'actine ont été identifiées:
elles sont impliquées dans des fonctions aussi
diverses que la consolidation des filaments (ex: tropomyosine),
la formation de faisceaux de filaments ou "bundles"
(ex: fimbrine), la fragmentation des filaments (ex: gelsoline),
le mouvement des vésicules sur les filaments (ex:
myosine II) ou encore l'ancrage des filaments à la membrane
plasmique (ex: spectrine). Tous ces jeux de protéines
liant l'actine peuvent agir de façon coopérative pour engendrer
les mouvements de la surface cellulaire, la phagocytose et la locomotion
cellulaire.
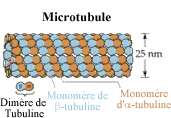
II- LES MICROTUBULES
Les microtubules sont des tubes creux, de 24 nm de diamètre,
constitués de 13 protofilaments de tubuline, chaque molécule
de tubuline étant un hétérodimère d'a
et de b-tubuline.
Dans les cellules animales, les microtubules se dépolymérisent
et se repolymérisent continuellement, constituant un réseau
dynamique (énergie fournie par le GTP) polarisé qui irradie
du centrosome vers la périphérie.
Comme dans le cas de l'actine, des protéines peuvent, selon les
types cellulaires, exercer une stabilisation des microtubules. Ces protéines,
appelées MAP ("Microtubule Associated Protein"), sont
capables de stabiliser les microtubules en des localisations précises
du cytoplasme; ainsi, dans les neurones, la protéine MAP2 est présente
dans les dendrites et le corps cellulaire, mais absente de l'axone, où
sont trouvées certaines formes de protéine Tau, suggérant
un rôle des MAPs dans la compartimentation cytoplasmique et l'orientation
sélective des microtubules.
Le réseau microtubulaire intervient particulièrement dans
la mobilité intra- et extra-cellulaire, dans la morphologie et
la division cellulaire par deux mécanismes distincts: d'une part
l'assemblage et le désassemblage des microtubules permettent la
migration d'un "cargo" lié à l'une des extrémités;
d'autre part, les microtubules peuvent constituer de véritables
rails, sur lesquels des moteurs moléculaires, ayant lié
un cargo, peuvent se déplacer.

Ainsi des molécules de la famille des kinésines
permettent le transport du pôle négatif au pôle positif
du microtubule (transport antérograde, c'est-à-dire du centre
de la cellule vers la périphérie), tandis que la dynéine
permet un transport du pôle positif vers le pôle négatif
(transport rétrograde, c'est-à-dire de la périphérie
vers le centre cellulaire).
III- LES FILAMENTS INTERMEDIAIRES
Ce sont des fibres de 10 nm de diamètre, réparties
dans la cellule selon une distribution similaire à celle des microtubules,
c'est-à-dire concentrés autour du noyau et irradiant vers
la périphérie de la cellule.
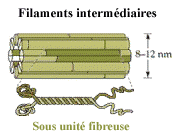
Les filaments intermédiaires sont regroupés
selon 5 classes de protéines: kératines de type acide, kératines
de type basique, vimentine et apparentés (ex : desmine, glial fibrillary
acidic protein..), neurofilaments et lamines (dans le noyau). A l'inverse
des microfilaments d'actine et des microtubules, les filaments intermédiaires
ne présentent pas de polarité, et donc n'interviennent pas
dans le transport directionnel. Ils interviennent surtout dans le maintien
de la morphologie cellulaire, dans la résistance aux stress mécaniques
et dans le maintien d'une cohésion entre les cellules (ex: épithélium)
via l'ancrage aux desmosomes et plaques d'adhérence.
IV- ROLE DU CYTOSQUELETTE DANS
LE TRANSPORT VIRAL
De la périphérie
vers le centre de la cellule : transport rétrograde
Les virus pénètrent dans la cellule par fusion de leur enveloppe
virale avec la membrane plasmique ou, dans le cas d'endocytose récepteur-dépendante,
par libération de la capside virale à partir de l'endosome.
Pour beaucoup de virus, les étapes précoces de transport
impliquent le réseau d'actine (ex: vaccine, VIH). Mais le transport
vers le centre cellulaire (et pour nombre de virus, vers le noyau) implique
l'utilisation du réseau microtubulaire. De nombreux virus utilisent
dans ce cadre un transport rétrograde le long des microtubules,
impliquant la dynéine cytoplasmique. Ceci a pu être démontré
initialement pour le virus herpes simplex 1 (HSV -1), notamment par des
expériences de dépolymérisation de microtubules,
de co-localisation en immunocytochimie ou de vidéo-microscopie.
Sur un modèle d'axone géant de calmar, Bearer et al. ont
pu évaluer la vitesse d'un tel transport, 2.2 mm/sec., ce qui est
compatible avec le transport rétrograde médié par
la dynéine. Différentes approches ont montré l'implication
des protéines du tégument du virus dans l'interaction avec
la dynéine. Ces données ont été confortées
par la découverte, pour d'autres virus, de protéines virales
capables d'interagir avec une sous-unité de la dynéine,
comme par exemple l'interaction de la phosphoprotéine du virus
rabique avec la sous-unité LC8 de la dynéine (Jacob et al.,
2000). La sous-unité LC8 de la dynéine est également
impliquée dans le transport du virus ASFV (African Swine Fever
Virus) (Alonso et al., 2001).
Du centre de la cellule vers la
périphérie : transport antérograde
Ce type de transport est requis pour la libération des virions
néo-formés. Il n'est pas indispensable dans le cas de virus
libérés par lyse cellulaire. En revanche, dans le cas de
bourgeonnement viral à la membrane plasmique, le réseau
microtubulaire sera utilisé, par l'intermédiaire de moteurs
du transport antérograde de la famille des kinésines. Ainsi,
il a été démontré que le virus HSV -1 utilisait
le réseau microtubulaire dans les stades tardifs de l'infection
pour sa libération à la périphérie du neurone
(Miranda-Saskena, 2000). De même, le rétrovirus MuL V (Murine
Leukemia Virus), est capable, par l'intermédiaire de la protéine
structurale de capside Gag, de se lier à un moteur de type kinésine
(KIF4) pour être acheminé du centrosome vers la périphérie
(Kim et al., 1998). Ce rôle de la protéine Gag a également
été démontré pour les virus HIV et SIV, pour
un transport le long des microtubules, avant de faire intervenir le réseau
d'actine au voisinage de la membrane plasmique pour permettre le bourgeonnement.
Dans un tel contexte, le transport dépendant des microtubules concernerait
plutôt le transport sur de longues distances dans la cellule, tandis
que le réseau d'actine interviendrait dans les transports sur de
courtes distances, notamment en ce qui concerne les phases de bourgeonnement
viral. Un cas singulier est cependant fourni par le virus de la vaccine,
qui est capable d'être propulsé par de véritables
"comètes" d'actine, en utilisant la polymérisation
de cette dernière (Wolffe et al., 1997), à l'instar de ce
qui a été observé pour des bactéries intra-cellulaires
telle Listeria ou Shigella, mais pourrait également utiliser le
réseau microtubulaire pour être transporté vers la
périphérie (Hollinshead et al., 2001).
Pour résumer :

Représentation schématique des différentes
étapes du transport viral intra-cellulaire
V- ALTERATIONS VIRO-INDUlTES DU
CYTOSQUELETTE
Outre les effets du cytosquelette dans le cycle viral,
notamment dans le transport viral, l'infection d'une cellule par un virus
peut se traduire par une altération du cytosquelette. Quelques
exemples de telles altérations sont:
Altérations du cytosquelette
d'actine
Des cellules de neuroblastome d'origine murine infectées par le
virus rabique montrent une baisse de marquage de l'actine F (marquage
à la phalloïdine couplée à la rhodamine). Ces
modifications ne sont pas dues à une action directe sur la polymérisation
de l'actine G en actine F (spectroscopie de fluorescence) mais à
une action de la nucléocapside rabique sur le compactage des fibres
d'actines en faisceaux (bundles) par des molécules neuronales telle
la synapsine 1 (vidéo-microscopie) (Ceccaldi et al., 1997).
Un autre exemple d'altération du réseau d'actine concerne
une action directe de l'infection sur la polymérisation de l'actine:
l'infection par le cytomégalovirus est capable de désorganiser
le cytosquelette d'actine par dépolymérisation des microfilaments
d'actine (Jones, 1986). Altérations du réseau microtubulaire.
Les microtubules sont une cible pour de nombreux virus; un des exemples
les mieux étudiés est l'infection par le virus de la vaccine.
Ce dernier est capable d'altérer les fonctions du centrosome, provoquant
une réorganisation du réseau microtubulaire (Ploubidou et
al., 2000).
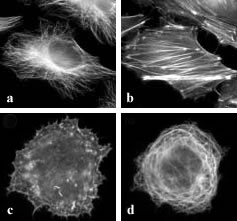
Image en microscopie à
fluorescence (Ploubidou & Way,2001)
a- Microtubule de cellules non infectées
b- Actine de cellules non infectées
c- Microtubule de cellules infectées par le virus de la Vaccine
d- Actine de cellules infectées par le virus de la vaccine
|
Altérations des filaments
intermédiaires
L'infection de cellules en culture par le virus simien SV 40 provoque,
au bout de 36 à 48 heures, une baisse dramatique de la synthèse
de vimentine, en parallèle avec une désorganisation du réseau
des filaments intermédiaires (Ben-Ze'ev, 1984), sans altération
du réseau de microtubules et d'actine.
BIBLIOGRAPHIE:
Revues récentes sur les interactions virus-cytosquelette :
Ploubidou & Way, « Viral transport and the cytoskeleton»
; CurT. Opin. Cell Biol., 2001 ; 13 ; 97-105
Lecellier et al., « Le cytosquelette et les virus, ou comment se
déplacer dans une cellule » ; Virologie (janvier 2002).
Transport viral:
Alonso et al., J. Virol., 2001, 75, 9819-9827
Bearer et al., Proc. Nat! Acad. Sci. USA, 2000, 97, 8146-8150
Hollinshead et al., J. Cell Biol., 2001, 154, 389-402
Jacob et al., J. Virol., 2000, 74, 10217-10222
Kim et al., J. Virol., 1998, 72, 6898-6901
Miranda-Saksena et al., J. Virol., 2000, 74, 1827-1839
Wolffe et al., J. Virol., 1997,71,3904-3915
Altérations viro-induites du cytosquelette:
Ben-Ze'ev, Mol. Cell. Biol., 1984, 4
Ceccaldi et al., J. Gen. Virol., 1997,78,2831-2835
Jones et al., Eur. J. Cell Biol., 1986,41,304-312
Ploubidou et al., EMBO J., 2000, 19, 3932-3944
|